Bipolaris - Blattflecken
Helminthosporioses des graminées (fr.), Bipolaris diseases (engl.)
Wissenschaftlicher Name: Bipolaris sorokiniana (Sacc.) Shoemaker
Synonyme: Helminthosporium sativum Pammel, King & Bakke, H. sorokinianum Sacc., Drechslera sorokiniana (Sacc.) Subram. & Jain
Hauptfruchtform: Cochliobolus sativus (Ito & Kuribayashi) Drechsler ex Dastur
Taxonomie: Fungi, Ascomycota, Dothideomycetes, Pleosporomycetidae, Pleosporales, Pleosporaceae, Bipolaris
Bipolaris sorokiniana ist weltweit verbreitet, kommt aber eher in warmen, trockenen Gegenden vor. In West- und Nordeuropa verursacht dieses Pathogen nur selten einen grösseren Schaden. Der Pilz befällt über 100 Gräserarten (Sprague, 1950), unter anderem auch die Gerste und den Weizen. B. sorokiniana verursacht Keimlingskrankheiten, Blattflecken und in warmen Gebieten auch eine Wurzelfäule.
 Abb. 1. Bipolaris sorokiniana Blattflecken an Wiesenschwingel (Festuca pratensis) und Gerste (Hordeum vulgare)
Abb. 1. Bipolaris sorokiniana Blattflecken an Wiesenschwingel (Festuca pratensis) und Gerste (Hordeum vulgare)
Schadbild
Ausgehend von befallenen Samen können Keimlinge infiziert werden. Sie sterben bereits vor dem Auflaufen oder zeigen an der Koleoptile sowie auf dem Primärblatt braunschwarze, längliche Nekrosen. Die Jungpflanzen welken und werden abgetötet.
An den Blättern von älteren Pflanzen verursacht B. sorokiniana zahlreiche kleine Flecken, was sie gesprenkelt aussehen lässt. Die Flecken sind dunkelbraun, zuerst rundlich, später länglich und sind von einem gelben Hof umgeben. Das Zentrum älterer Flecken ist oft heller. Die einzelnen Flecken fliessen mit der Zeit zusammen und das ganze Blatt wird zerstört.
In warmen trockenen Gebieten befällt der Pilz auch den Wurzelhals und die Wurzeln. Diese verfärben sich schwarz und faulen. Die Pflanzen lassen sich leicht aus dem Boden ziehen.
Durch B. sorokinia verursachte Symptome sind häufig kaum von denjenigen der Drechslera Arten zu unterscheiden. Für eine exakte Bestimmung des Pathogens müssen die Blätter in einer Feuchtkammer inkubiert und anschliessend mit der Lupe oder dem Mikroskop untersucht werden.
Krankheitserreger
Die Konidienträger wachsen einzeln oder in kleinen (2-3) Gruppen aus den Spaltöffnungen oder, nachdem das Pflanzengewebe abgestorben ist, zwischen den Epidermiszellen (Abb. 2, 3 und 4). Sie sind gerade oder gekrümmt, manchmal kniegelenkartig abgewinkelt, septiert und braun gefärbt (Sprague, 1950). Die Länge beträgt nach Ellis (1971) bis zu 220 µm, die Dicke 6-10 µm.
Die Konidien sind gerade oder sanft gebogen (Form eines Bumerangs), spindelförmig, mit glatter Oberfläche und dunkelbraun (Abb. 4). Sie haben 3-12 (meistens 6-10) Pseudosepten (= unvollständige Septen), sind 40-120 (meistens 60-100) µm lang und 17-28 (meistens 18-23) µm breit (Ellis, 1971). Nach Ammon (1963) variiert die Grösse der Konidien jedoch je nach Umwelt und Wirtspflanze beträchtlich.
Im Gegensatz zu den Drechslera Arten sind die Konidien von B. sorokiniana eher spindelförmig (an beiden Enden spitz zulaufend), gebogen und deutlich dunkler pigmentiert (Abb. 5). Die Konidien keimen bipolar (Abb. 6): Keimschläuche werden nur von den beiden Endzellen gebildet, diese verlaufen zudem mehr oder weniger parallel zu der Konidienachse.
Die Hauptfruchtform entwickelt sich auf abgestorbenem Pflanzengewebe oder auf künstlichen Nährmedien (Tinline, 1951). Ascocarp, Asci und Ascosporen wurden von Smith et al. 1989 ausführlich beschrieben.
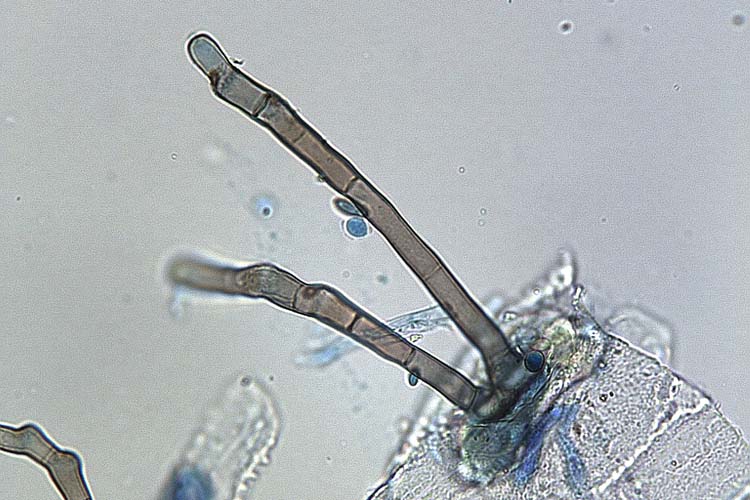 Abb. 2. Konidienträger von B. sorokiniana
Abb. 2. Konidienträger von B. sorokiniana
 Abb. 3. Konidienträger mit Konidien von B. sorokiniana (dunkelbraune Konidien) und D. siccans auf abgestorbenen Blättern von Englischem Raigras (Lolium perenne)
Abb. 3. Konidienträger mit Konidien von B. sorokiniana (dunkelbraune Konidien) und D. siccans auf abgestorbenen Blättern von Englischem Raigras (Lolium perenne)
 Abb. 4. Konidienrasen (B. sorokiniana) an Gerste
Abb. 4. Konidienrasen (B. sorokiniana) an Gerste
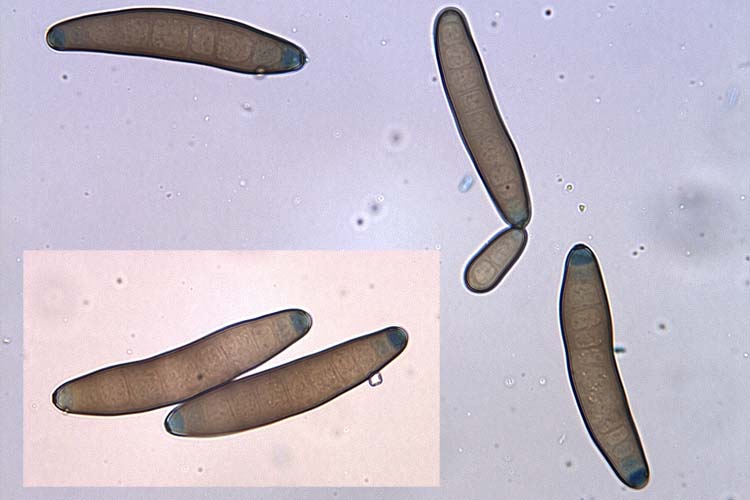 Abb. 5. Konidien der B. sorokiniana
Abb. 5. Konidien der B. sorokiniana
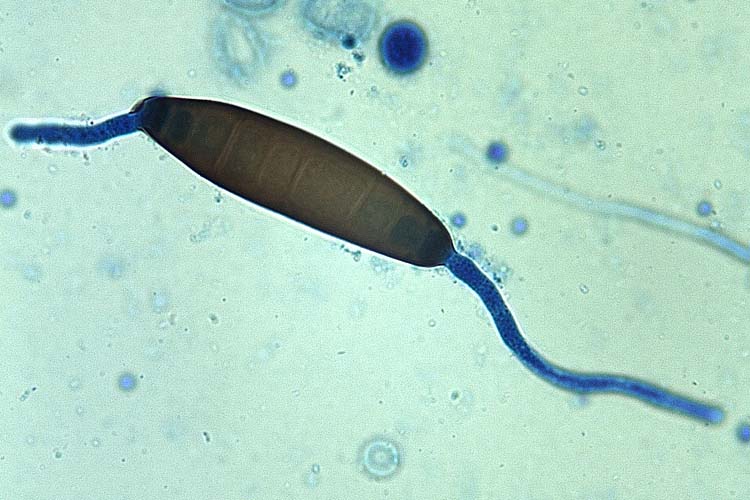 Abb. 6. Die Konidien der Bipolaris sorokiniana keimen bipolar, an beiden Endzellen der Konidie werden Keimschläuche gebildet, diese verlaufen zudem mehr oder weniger parallel zu der Konidienachse.
Abb. 6. Die Konidien der Bipolaris sorokiniana keimen bipolar, an beiden Endzellen der Konidie werden Keimschläuche gebildet, diese verlaufen zudem mehr oder weniger parallel zu der Konidienachse.
Lebenszyklus
Aus den mit B. sorokiniana infizierten Samen wachsen Keimlinge, welche entweder bereits vor dem Auflaufen absterben oder an den Koleoptilen eine dunkle Fäule zeigen. Diese Fäule breitet sich nach und nach auf die Blätter, Wurzelhals, Wurzeln und Adventivwurzeln aus. An den befallenen Pflanzenteilen werden Konidien gebildet, die mit Regentropfen weggespritzt oder mit dem Wind verbreitet werden. Sobald die Konidien auf oberirdisches Pflanzenmaterial einer Wirtspflanze gelangen, verursachen sie dort bei günstigen Bedingungen eine Neuinfektion. Diese führen zur Bildung neuer Konidien, die für eine weitere Verbreitung der Krankheit im Pflanzenbestand sorgen.
B. sorokiniana kann auch als Saprophyt im Boden überleben. Er zeigt allerdings eine wenig konkurrenzfähige saprophytische Aktivität. Die Sporenbildung und -keimung wird zudem im Boden gehemmt (Simmonds et al., 1950). Trotzdem sind die Konidien, welche auf abgestorbenen Pflanzenteilen gebildet werden, eine weitere wichtige Quelle für Infektionen.
Die Blätter werden über die Spaltöffnungen oder direkt durch die Zellwände, mit vorgängiger Bildung von Appressorien, infiziert. Mit zunehmender Temperatur kommt es neben der Bildung von Blattflecken auch zur Zerstörung ganzer Blätter, des Wurzelhalses und der Wurzeln.
Epidemiologie
B. sorokiniana schädigt die Gräser vor allem während eines heissen Sommers: Je höher die Temperaturen desto grösser der Schaden. Bei Temperaturen von 20 - 25 °C verursacht der Pilz vor allem Blattflecken, erst ab 30 °C werden die Blätter zerstört und ab 35 °C werden ganze Pflanzen vernichtet (Smith et al. 1989).
Nach Shoemaker (1955) ist die Konidienbildung bei 28 °C und hoher Luftfeuchtigkeit optimal. Abwechselndes Trocknen und Anfeuchten der befallenen Blätter scheint die saprophytischen und parasitischen Aktivitäten zu fördern: Die Keimung der Konidien, das Myzelwachstum und die Infektion wird angeregt. Nach einer Trockenperiode nimmt folglich der Krankheitsverlauf deutlich zu.
Wirtsspektrum
Der Krankheitserreger ist nicht auf einzelne Arten spezialisiert. Sprague (1950) zählt zum Wirtspflanzenkreis über 100 Grasarten, darunter auch wichtige Futtergräser und Getreidearten: Avena sativa, Bromus catharticus, Dactylis glomerata, Festuca elatior, F. rubra, Hordeum vulgare, Lolium perenne, Phleum pratense, Poa pratensis, Secale cereale, Triticum aestivum, T. spelta und Zea mays. Andersen (1955) listet ausserdem unter anderem auch Festuca pratensis und Lolium multiflorum als Wirtspflanzen auf.
Innerhalb der Art B. sorokiniana gibt es Isolate, die sich auf bestimmte Wirtspflanzen spezialisiert haben. Isolate von Wiesenschwingel (Festuca pratensis) konnten die Gerste, den Weizen, Rohrschwingel, Knaulgras und das Italienische Raigras nur schwach befallen (Schmidt, 1983).
Vorbeugende Bekämpfungsmassnahme
In Westeuropa ist B. sorokiniana keine gefährliche Krankheit der Gräser. Die Wahl von resistenten Sorten bei der Aussaat ist eine mögliche Strategie, Ausfälle zu verhindern. Die ausgewählten Sorten sollten aber auch gegen die anderen, wichtigeren Blattfleckenerreger und Rostpilze eine gute Resistenz zeigen.
Literatur
Ammon HU, 1963. Über einige Arten aus den Gattungen Pyrenophora Fries und Cochliobolus Drechsler mit Helminthosporium als Nebenfruchtform. Phytopathologische Zeitschrift 47: 244-300.
Andersen HH, 1955. Species of Helminthosporium on cereals and grasses in Denmark. Friesia 5: 80-89.
Ellis MB, 1971. Dematiaceous Hyphomycetes. Commenwealth Mycological Institute Kew, Surrey England: 608 p.
Schmidt D, 1983. Drechslera sorokiniana sur fétuque des prés à Changins. Revue Suisse Agriculture 15 (4): 171-175.
Shoemaker RA, 1955. Biology, cytology and taxonomy of Cochliobolus sativus. Canadian Journal of Botany 33: 562-576.
Smith JD, Jackson N and Woolhouse AR, 1989. Fungal Diseases of Amenity Turf Grasses. E. & F.N. Spon, London.
Simmonds PM, Sallans BJ and Ledingham RJ, 1950. The occurrence of Helminthosporium sativum in relation to primary infections in common root rot of wheat. Science of Agriculture 30: 407-417.
Sprague R, 1950. Diseases of cereals and grasses in North America (Fungi, except smuts and rusts). The Ronald press Company, N.Y.: 538 S.
Tinline RD, 1951. Studies on the perfect stage of Helminthosporium sativum. Canadian Journal of Botany 29: 467-478.




