Weizenbraunrost
rouille brune (franz.), wheat leaf rust or brown rust (engl.)
Wissenschaftlicher Name: Puccinia triticina Eriks.
Synonyme: Uredo rubigo-vera DC., Puccinia rubigo-vera (DC.) Winter, P. recondita Dietel & Holw., P. recondita f.sp. triticina D.M. Hend., P. recondita f.sp. tritici C.O. Johnson, P. dispersa Erikss. & Henning, P. dispersa f.sp. tritici Erikss. & Henning
Der wissenschaftliche Name des Roggenbraunrosts ist Puccinia recondita und des Braun- oder Zwergrosts der Gerste Puccinia hordei.
Taxonomie: Fungi, Basidiomycota, Pucciniomycetes, Pucciniales, Pucciniaceae
Weizenbraunrost (Puccinia triticina) ist ein wirtswechselnder Rostpilz mit vollständigem Entwicklungsgang. Brotweizen und Dinkel sind die wichtigsten Hauptwirte. Als Zwischenwirt dient die Wiesenraute (Thalictrum speciosissimum). Die rostbraunen Sommersporenlager (Uredolager) wachsen vorwiegend an der Blattoberseite und sind über die ganze Blattfläche verteilt. Im Herbst werden an der Blattunterseite schwarze Wintersporenlager (Teleutosporenlager) gebildet. In gemässigten Klimas ist der Braunrost nicht auf den Zwischenwirt angewiesen. Er überdauert hier den Winter meist als Myzel oder in Form von Sommersporen an Ausfallgetreide und/oder Winterweizen. Die wichtigste Massnahme zur Vermeidung von Ertragseinbussen durch Braunrost ist die Wahl von resistenten oder wenig anfälligen Weizensorten.

 Abb. 1. Weizenbraunrost (Puccinia triticina): Uredolager
Abb. 1. Weizenbraunrost (Puccinia triticina): Uredolager
 Abb. 2. Weizenbraunrost (Puccinia triticina): Teleutolager
Abb. 2. Weizenbraunrost (Puccinia triticina): Teleutolager
Schadbild
Die rostbraunen Uredolager (Sommersporen) wachsen vorwiegend an der Blattoberseite (Abb. 1 und 3). Sie sind zerstreut über die ganze Blattfläche verteilt (und nicht in Reihen oder Streifen angeordnet wie beim Gelbrost, P. striiformis), selten auch an den Blattscheiden und Ähren. Die Lager sind rundlich, haben einen Durchmesser von etwa 2 mm und sind meist von einem gelben Hof umgeben. Im Unterschied zum Schwarzrost (P. graminis) bleiben am Rande der Lager nur wenige Epidermisreste hängen.
Gegen Ende der Vegetation werden an der Blattunterseite, gelegentlich auch an der Blattscheide, Teleutosporenlager (Wintersporen) gebildet. Sie sind schwarz, länglich und von der Epidermis bedeckt (Abb. 2 und 3).
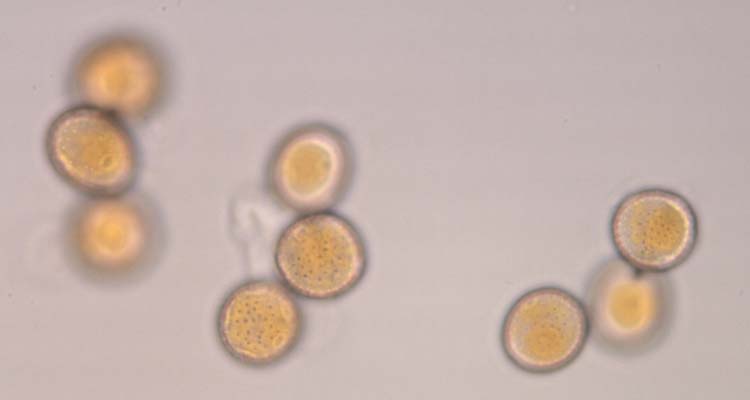
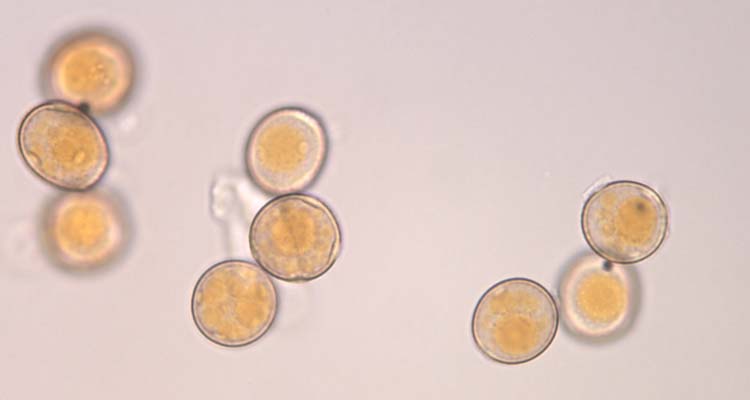 Abb. 4. Weizenbraunrost (Puccinia triticina): Uredosporen (Sommersporen) mit Stachelwarzen (oben) und Keimporen (unten)
Abb. 4. Weizenbraunrost (Puccinia triticina): Uredosporen (Sommersporen) mit Stachelwarzen (oben) und Keimporen (unten)
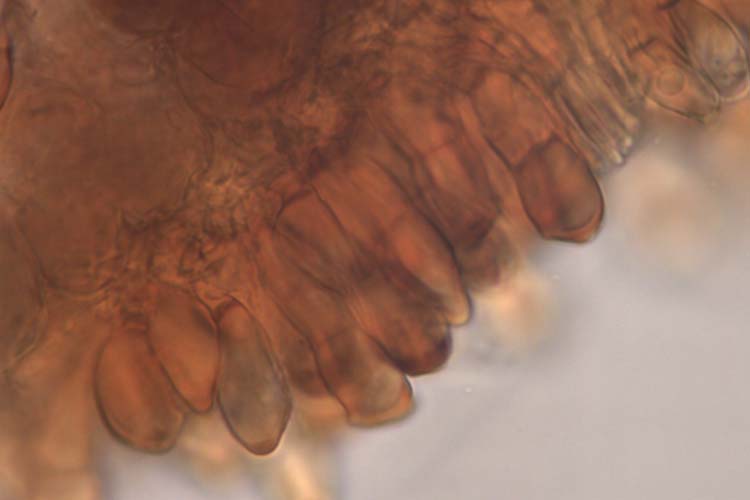
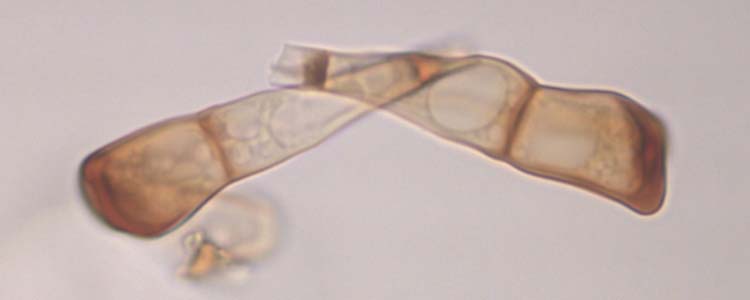 Abb. 5. Weizenbraunrost (Puccinia triticina): Schnitt durch Teleutolager (oben) und Teleutosporen (Wintersporen) (unten)
Abb. 5. Weizenbraunrost (Puccinia triticina): Schnitt durch Teleutolager (oben) und Teleutosporen (Wintersporen) (unten)
Pathogen
Die Uredosporen (Abb. 4) sind kugelig bis ellipsoidisch und im Mittel 23.2 µm lang und 20.4 µm breit (Anikster et al 2005). Sie haben 8-10 gleichmässig verteilte Keimporen und sind mit Stachelwarzen versehen (Gäumann 1959). Die Uredosporen sind orangebraun (nicht hyalin wie bei P. striiformis). Es gibt keine Paraphysen in den Uredolagern.
Die braunen bis schwarzen Teleutosporen sind zweizellig (Abb. 5), länglich keulenförmig (45.9 µm lang und 16.3 µm breit, Anikster et al. 2005), oft abgestumpft oder schräg abgestutzt. Die untere Zelle ist meist schmäler und länger als die obere. Die Keimporen sind nicht sichtbar. Der Stiel ist kurz. Bräunliche Paraphysen unterteilen die grossen Lager in kleinere Lager.
Nach Anikster et al. 2005 messen die Basidiosporen 8.27 x 6.28 µm, die Spermatien 3.93 x 2.28 µm und die Aecidiosporen 20.1 x 17.1 µm.
Lebenszyklus
Weizenbraunrost ist ein wirtswechselnder (heterözischer) Rostpilz mit vollständigem (makrozyklischem) Entwicklungsgang. Er bildet die dikaryotischen Uredosporen in Uredolagern an Weizenblättern. Die Uredosporen infizieren wiederholt den Weizen und unter günstigen Witterungsbedingungen kommt es zu einer epidemieartigen Ausbreitung des Rostpilzes. Mit zunehmender Reife des Weizens werden, ebenfalls an Weizenblättern, die Teleutosporen in Teleutolagern gebildet. Diese sind vorerst ebenfalls dikaryotisch. Die beiden haploiden Zellkerne verschmelzen aber schon bald zu einem diploiden Zellkern (Karyogamie).
Die Teleutosporen sind Dauersporen und können den Winter überdauern. Im Mittelmeerraum dienen die Teleutosporen hingegen der Überbrückung des heissen, trockenen Sommers. In gemässigten Klimas ist der Braunrost nicht unbedingt auf den Zwischenwirt angewiesen.Hier überdauert er den Winter meist als Myzel oder in Form von Uredosporen auf Ausfall- und/oder Winterweizen.
Im Frühjahr (im Mittelmeerraum im Herbst) keimt eine oder beide Zellen der Teleutospore mit einem Promyzel. Der diploide Zellkern teilt sich in einer Meiose in vier haploide Zellkerne. Diese wandern in das Promyzel, welches sich anschliessend mittels Septen in vier Zellen mit je einem haploiden Zellkern unterteilt. Letzterer fliesst anschliessend durch die Sterigmen in die neu entstehenden Basidiosporen. Die Basidiosporen werden abgestossen und gelangen mit der Luftströmung auf den Zwischenwirt, die Wiesenraute (Thalictrum speciosissimum). Dort keimen die Basidiosporen und dringen direkt in das Blatt ein. Es kommt zur Bildung von flaschenförmigen Spermogonien (Pyknidien), in denen Spermatien (früher Pyknosporen genannt) und Empfängnishyphen gebildet werden. Regentropfen, Tau oder Insekten, angelockt durch ein von den Spermogonien ausgeschiedenen „Nektar", übertragen die Spermatien auf sexuell kompatible Empfängnishyphen. Nach der Befruchtung entwickeln sich auf der Blattunterseite Aecidien, in denen in Ketten angeordnete, dikaryotische Aecidiosporen wachsen. Diese Sporen infizieren nun wiederum den Hauptwirt, den Weizen.
Infektionsvorgang und Resistenzreaktion
Uredosporen können mit dem Wind über mehrere Kilometer verbreitet werden. Gelangt eine Uredospore auf ein anfälliges Weizenblatt und ist dort ein Wasserfilm vorhanden (Regen oder Tau), keimt sie bei 20 °C bereits nach 4 bis 8 Stunden. Der Keimschlauch wächst an der Blattoberfläche senkrecht zu der Längsachse der Epidermiszellen bis er auf eine Spaltöffnung (Stomata) trifft. Dort wird ein Appressorium gebildet. Eine Penetrationshyphe dringt durch die geschlossene Spaltöffnung in die Pflanze und bildet in den Pflanzenzellen Haustorien. Das sind spezialisierte pilzliche Hyphen, die der Nährstoffversorgung des Pilzes dienen, ohne dabei die Wirtszelle abzutöten.
Gelangt eine Uredospore auf eine resistente Weizenpflanze dringt diese wie oben beschrieben in das Blatt ein. Die Entwicklung des Haustoriums wird aber verhindert, weil die Pflanzenzelle eine hypersensitive Resistenzreaktion auslöst, durch die sich die Zelle selbst tötet.
Sieben bis zehn Tage nach Beginn der Infektion entstehen unter der Epidermis die ersten Uredosporen. Sobald genügend Sporen gebildet wurden bricht die Epidermis auf und die Sporen werden vom Wind verbreitet. An sehr anfälligen Weizenpflanzen werden rund um das primäre Uredolager noch weitere, sekundäre Lager gebildet. Auch 16 Tage nach dem Eindringen des Pilzes in die Pflanze sind erst wenige Pflanzenzellen abgestorben.
Braunrostrassen
Rassen unterscheiden sich in ihrer Fähigkeit, bestimmte Weizensorten zu befallen oder eben nicht zu befallen. Die Braunrostpopulationen sind weltweit sehr divers. In den USA konnten in einem Jahr bis zu 70 verschiedene Weizenbraunrostrassen identifiziert werden (Kolmer et al. 2007). In Frankreich wurden 30-50 (Goyeau et al. 2006), in Australien 10-15 Rassen (Park 1996) bestimmt.
Neue Braunrostrassen entstehen auf dem Zwischenwirt durch Genrekombination oder durch natürlich vorkommende, zufällige Mutationen in den Uredosporen. Häufig kommt es vor, dass Rostrassen in ein Gebiet einfliegen oder eingeschleppt werden, wo sie bis anhin nicht auftraten. Dies kann bei den Rostpilzen über sehr grosse Distanzen stattfinden.
Epidemiologie
Weizenbraunrost entwickelt sich bei hohen Temperaturen (25 °C) am Tag und kühlen Nächten (unter 15 °C) mit Taubildung besonders gut (Häni et al. 2008). Der Anbau von anfälligen Sorten, eine hohe Stickstoffversorgung und der Einsatz von Wachstumsreglern fördern den Braunrost zusätzlich und ermöglichen eine rasche Vermehrung des Rostpilzes. Die Krankheit erscheint meistens relativ spät und verursacht deshalb nur selten, ausser bei spät reifenden Sorten, einen ins Gewicht fallenden Ertragsausfall. Myzel und Uredosporen überleben tiefe Temperaturen problemlos, was dem Rostpilz ermöglicht, auch ohne Zwischenwirt in der Region zu überleben.
Wirtsspektrum
Puccinia triticina befällt in der Dikaryophase Brotweizen (Triticum aestivum L.), Dinkel oder Spelt (T. aestivum subsp. spelta (L.) Thell.), tetraploiden Hartweizen (T. durum) und den ebenfalls tetraploiden Emmer (T. turgidum var. dicoccum Schübler).
Zwischenwirt der P. triticina ist die gelbe Wiesenraute (Thalictrum speciosissimum = T. flavum) (Anikster et al. 1997).
Weizensorten unterscheiden sich in der Anfälligkeit gegenüber Braunrost. Sie tragen ein oder mehrere Resistenzgene. Diese können von bestimmten Braunrostrassen überwunden werden (= Rostrasse ist virulent), was zu einer Infektion und zur Bildung von Uredosporen führt. Pflanzen die Resistenzgene enthalten, welche von dieser bestimmten Rasse nicht überwunden werden können (= Rostrasse ist avirulent), bleiben gesund.
Die Pflanzenzüchter versuchen breit wirksame Resistenzgene in einer Weizensorte zu vereinen, um diese gegen möglichst viele Rostrassen dauerhaft resistent zu machen. Die Resistenzzüchtung erleidet aber immer wieder Rückschläge, da neue Rostrassen entstehen oder neue Rassen in ein vorher nicht besiedeltes Gebiet einwandern können. Deshalb wird weiterhin in Landrassen, verwandten Arten, Wild- und Urformen des Weizens nach neuen Resistenzgenen gesucht. Diese sind jedoch meist mit Genen gekoppelt, die negative agronomische Eigenschaften vererben, so dass sie nicht genutzt werden können.
Vorbeugende Massnahmen und Bekämpfung
- Die wichtigste Massnahme zur Vermeidung von Ertragseinbussen durch Braunrost ist die Wahl von resistenten Weizensorten. In der Liste der empfohlenen Getreidesorten (Schweiz: Liste der empfohlenen Getreidesorten; Deutschland: Sortenliste des Bundessortenamtes; Österreich: Österreichische beschreibende Sortenliste) werden die Resistenzeigenschaften der Sorten beschrieben. In einigen Fällen können auch Sortenmischungen empfohlen werden.
- Winterweizen soll nicht zu früh (weniger Herbstinfektionen) und Sommerweizen nicht zu spät gesät werden (Häni et al. 2008).
- Um den Lebenszyklus des Braunrosts zu unterbrechen, lohnt es sich, Ausfallgetreide vor dem Auflaufen der Herbstsaat zu beseitigen.
- Gut mit Stickstoff versorgte Weizenpflanzen sind anfälliger für Braunrost, deshalb soll der Stickstoff zurückhaltend eingesetzt und die Einzelgaben nicht zu hoch dosiert werden.
- Braunrost tritt relativ spät auf, weshalb meist keine chemische Bekämpfung nötig ist.
- Eine direkte Bekämpfung mit chemischen Pflanzenschutzmitteln ist möglich. In der Schweiz sind Betriebe, die gemäss dem ökologischen Leistungsnachweis (ÖLN) wirtschaften, verpflichtet, Pflanzenschutzmittel nur gemäss dem Schadschwellenprinzip anzuwenden. Schadschwellen, beziehungsweise Bekämpfungsschwellen, geben einen Anhaltspunkt, bei welcher Dichte eine Bekämpfung mit Pflanzenschutzmitteln erfolgen soll und wirtschaftlich sinnvoll ist.
Die Bekämpfungsschwelle für Braunrost an Weizen und Triticale ist in der Schweiz wie folgt festgesetzt (Agridea, Datenblätter Ackerbau): Während der Entwicklungsstadien 37 (Fahnenblattspitze sichtbar) bis 61 (Beginn Blüte) werden 40 Halme über die Felddiagonale eingesammelt und die 3 obersten, vollentwickelten Blätter pro Halm auf Befall kontrolliert. Anzahl befallene Blätter (von total 120) zählen. Die Bekämpfungsschwelle ist erreicht, falls bei anfälligen Sorten 1-5 Blätter (= 1-4 %), bei wenig anfälligen Sorten 10 Blätter (ca. 10%) befallen sind. - Empfohlene und zugelassene Pflanzenschutzmittel gegen Braunrost finden sie für die Schweiz im BLW Pflanzenschutzmittelverzeichnis (Bundesamt für Landwirtschaft); für Deutschland in der online Datenbank des BVL (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) und für Österreich im Pflanzenschutzmittelregister des BAES (Bundesamt für Ernährungssicherheit)
Literatur
Agridea, 2021. Datenblätter Ackerbau. AGRIDEA, CH-8315 Lindau (Bekämpfungsschwellen)
Anikster Y, Bushnell WR, Eilam T, Manisterski J, Roelfs AP, 1997. Puccinia recondita causing leaf rust on cultivated wheats, wild wheats and rye. Can. J. Bot. 75: 2082-2096.
Anikster Y, Eilam T, Bushnell WR, Kosman E, 2005. Spore dimensions of Puccinia species of cereal hosts as determined by image analysis. Mycologia 97 (2): 474–484.
Bolten MD, Kolmer JA, Garvin DF, 2008. Wheat leaf rust caused by Puccinia triticina. Molecular plant pathology 9 (5): 563-575.
Gäumann E, 1959. Beiträge zur Kryptogamenflora der Schweiz (Band XII): Die Rostpilze Mitteleuropas, Büchler und Co. 1407 S.
Goyeau H, Park R, Schaeffer B, Lannou C, 2006. Distribution of pathotypes with regard to host cultivars in French wheat leaf rust populations. Phytopathology 96: 264-273.
Häni FJ, Popow G, Reinhard H, Schwarz A, Voegeli U, 2008. Pflanzenschutz im nachhaltigen Ackerbau. Edition LMZ, 7. Auflage. 466 S.
Kolmer JA, Long DL, Hughes ME, 2007. Physiological specialization of Puccinia triticina on wheat in the United States in 2005. Plant disease 91: 979-984.
Park RF, 1996. Pathogenic specialization of Puccinia recondita f.sp. tritici in Australia and New Zealand in 1990 and 1991. Australasian Plant Pathology 25: 12-17.
