Gelbrost des Getreides
Gelbrost oder Streifenrost (de); rouille jaune (franz.); yellow rust, stripe rust, wheat stripe rust, barley stripe rust (engl.)
Wissenschaftliche Namen: Puccinia striiformis f.sp. tritici (an Weizen), P. striiformis f.sp. hordei (an Gerste)
Synonym: P. glumarum (Schm.) Eriksson et Henning;
Taxonomie: Fungi, Basidiomycota, Pucciniomycetes, Pucciniales, Pucciniaceae
Gelbrost (Puccinia striiformis) ist weltweit verbreitet und befällt neben dem Getreide auch zahlreiche Wiesengräser. Innerhalb dieser Art gibt es zahlreiche physiologische Formen, die morphologisch fast identisch sind, aber unterschiedliche Wirtspflanzen befallen. So lebt die P. striiformis f. sp. tritici beispielsweise als Parasit an Weizen, die f. sp. hordei hingegen an Gerste. Diese zwei spezialisierten Formen gehen in der Regel nicht auf andere Gräser über. Umgekehrt können Gelbrostformen der Wiesenrispe (P. striiformis f.sp. poae) oder des Knaulgrases (P. striiformis f. sp. dactylidis) Weizen oder Gerste nicht befallen.
Typisch für einen Gelbrostbefall sind die in Streifen angeordneten Rostpusteln an den Blättern. Die Gefahr einer Epidemie ist dann besonders gross, wenn im Vorjahr viel Ausfallgetreide stehen bleibt, ein milder Winter folgt und von April bis Juni häufig Regen fällt.

 Abb.1 Gelbrost oder Streifenrost an Weizen (Puccinia striiformis)
Abb.1 Gelbrost oder Streifenrost an Weizen (Puccinia striiformis)
Schadbild
Die kleinen, gelborangen Uredolager (0.5 bis 1 mm lang und 0.3-0.4 mm breit) wachsen an beiden Seiten der Blätter (Abb. 1 und 2). Blattscheiden und Halme werden dagegen selten befallen, die Ähren hingegen häufig. Anfangs treten die Rostpusteln nur vereinzelt auf. Dies kann bereits im Herbst der Fall sein. Das Myzel wächst in der Längsrichtung des Blattes weiter und bildet ständig neue Uredolager. Diese sind deshalb linienförmig aneinandergereiht und bilden lange chlorotische Streifen. Sie füllen den Raum zwischen zwei Blattadern aus und können sich über die ganze Länge des Blattes erstrecken. In den frühen Stadien einer Epidemie tritt Gelbrost im Feld nesterweise auf (Obst und Paul 1993).
Teleutosporenlager (Abb. 2: 5. und 6. Bild) entwickeln sich bevorzugt an Blattscheiden und Halmen. Sie sind dauernd von der Epidermis bedeckt und bilden lange, feine, braune bis schwarze Striche. Die Teleutolager sind durch bogenförmige Paraphysen in Fächer geteilt.
Krankheitserreger
Die Uredosporen (Abb. 3) sind kugelig oder kurz ellipsoidisch, 14-36 µm lang und 13-23 µm breit (Gäumann 1959). Ihre Wand ist farblos, nur 1-1.5 µm dick und mit Stachelwarzen besetzt. Die Uredosporen besitzen 5-14 (meistens 8-10) Keimporen. Ihr Inhalt ist orangefarben.
Die Teleutosporen sind kurz gestielt, meist mehr oder weniger keulenförmig, oft asymmetrisch, 24-73 µm lang und 13-24 µm breit. Sie sind am Scheitel abgeflacht oder seitlich in 1-2 stumpfen Fortsetzungen auslaufend (Abb. 4). Sie sind zweizellig, gelegentlich (2-17 %) kommen aber auch einzellige Teleutoporen (Mesosporen) vor. Teleutosporen sind bereits im Herbst keimfähig und behalten ihre Keimfähigkeit bis weit in den folgenden Frühsommer hinein (Gäumann 1959).
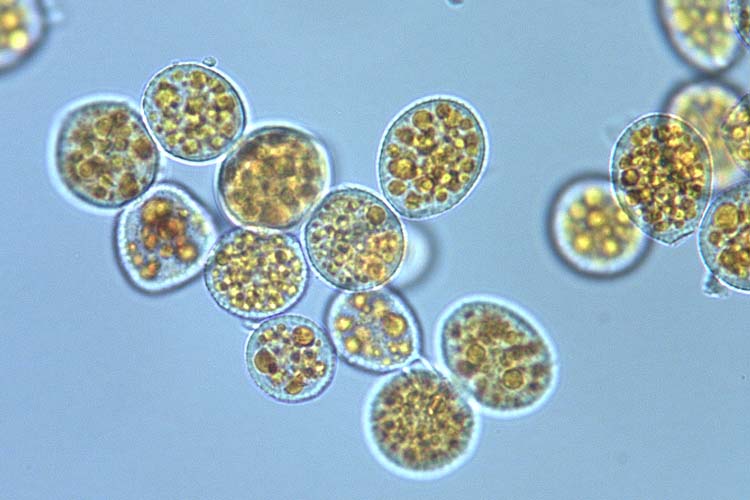 Abb. 3. Uredosporen der Puccinia striiformis f. sp. tritici, Verursacher des Gelb- oder Streifenrosts an Weizen
Abb. 3. Uredosporen der Puccinia striiformis f. sp. tritici, Verursacher des Gelb- oder Streifenrosts an Weizen
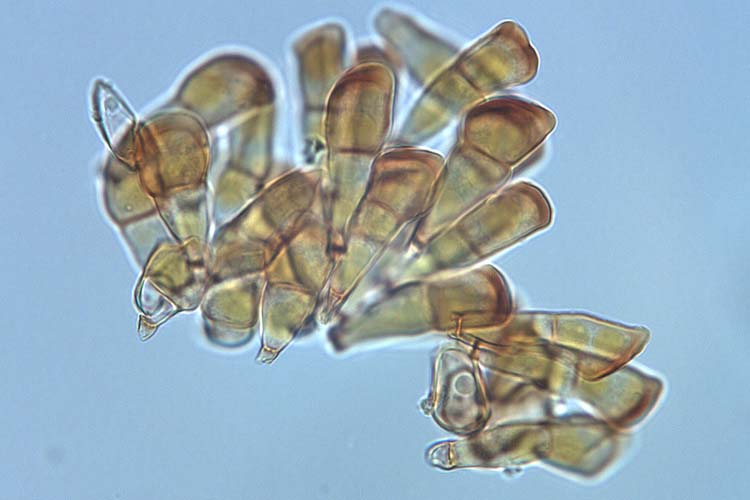 Abb. 4. Teleutosporen der Puccinia striiformis f.sp. tritici, Verursacher des Gelb- oder Streifenrosts an Weizen
Abb. 4. Teleutosporen der Puccinia striiformis f.sp. tritici, Verursacher des Gelb- oder Streifenrosts an Weizen
Lebenszyklus
Gelbrost ist ein obligater Parasit, der in unserem Klima in der Regel als dikaryotisches Myzel in den Blättern des Wintergetreides überwintern kann. Im Sommer und Herbst bildet er auf der Wirtspflanze (z.B. Weizen oder Gerste) massenweise Uredosporen (Abb. 3). Diese dringen über die Spaltöffnungen in das Blattgewebe ein. Von dort aus wächst das Myzel zwischen den Zellen weiter und bildet Haustorien in lebenden Pflanzenzellen.
Je nach Temperatur werden zwei bis vier Wochen nach der Infektion Uredolager mit Uredosporen gebildet. Im Gegensatz zu allen anderen Getreiderostarten breitet sich das Myzel entlang der Blattadern im Blatt aus und bildet zahlreiche Uredosporenlager, die als streifenförmig angeordnete Pusteln erscheinen. Durch die Ausbreitung im Blatt entstehen mehr Pusteln als durch Neuinfektionen. Innerhalb einer Vegetationsperiode können mehrere Infektionszyklen stattfinden. Die Uredosporen werden durch den Wind verbreitet, auch über grosse Distanzen.
Die Überwinterung des Gelbrosts erfolgt als Uredospore oder Myzel in Ausfall- oder Wintergetreide (Häni et al. 2008).
Der Gelbrost des Getreides bildet auch Teleutosporen. Diese sind zwar keimfähig, in der Schweiz jedoch vermutlich bedeutungslos, da bis heute noch nie Aecidien auf dem vermuteten Zwischenwirt Berberis spp. beobachtet wurden (Jin et al. 2010). Jin et al. konnten 2010 erstmals nachweisen, dass verschiedene Arten der Gattung Berberis (B. chinensis, B. holstii, B. korreana und B. vulgaris) Zwischenwirte von P. striiformis f. sp. poae und P. striiformis f. sp. tritici sind.
Epidemiologie
Gelbrost ist im Allgemeinen als eine Rostart bekannt, die eher in Gegenden mit feucht-kühlem Klima vorkommt (Hassebrauck, 1965). Je nach forma specialis (f. sp.) liegt die optimale Keimtemperatur zwischen 6 und 24 °C. Bei tiefen Temperaturen ist aber die Latenzzeit (Zeit zwischen Inokulation und Bildung neuer Uredosporen) jedoch länger. Der Pilz kann Temperaturen unter dem Gefrierpunkt überleben. Hohe Temperaturen, trockenes und sonniges Wetter sind für den Gelbrost aber nicht förderlich. Es werden keine Uredosporen mehr gebildet und der Rostpilz kann sogar absterben. Die Latenzzeit variiert je nach Klima, Resistenz des Wirtes und Virulenz des Pathogens zwischen 3 und 12 Wochen (Rapilly 1979).
Die Uredosporen des Gelbrostes können über weite Distanzen verbreitet werden. Trotzdem vermutet Rapilly (1979), dass die Krankheit eher endemisch vorkommt.
Die Sporen werden lokal durch den Aufprall von Regentropfen oder durch Windböen verbreitet.
Wirtsspektrum
Laut Gäumann (1959) gibt es mehr als 100 Pflanzenarten, die als Wirtspflanzen des Gelbrosts dienen. Dazu gehören neben den wichtigsten Getreidearten auch Futtergräser wie das Italienische Raigras (Lolium multiflorum), das Englische Raigras (L. perenne), die Wiesenrispe (Poa pratensis) und das Knaulgras (Dactylis glomerata).
Gäumann (1959) ordnete den Gelbrost einer Formart zu, in der bis zur Abklärung des Wirtswechsels sämtliche Grasroste mit gelborangefarbenen Uredolagern untergebracht werden, vor allem dann, wenn die Uredolager in Streifen auftreten und auch die Ähren befallen werden.
Innerhalb dieser Formart gibt es zahlreiche physiologische Formen, die morphologisch fast identisch sind, aber unterschiedliche Wirtspflanzen befallen. Manners (1960) kategorisierte diese aufgrund kleiner morphologischer Unterschiede in Varietäten. Viel üblicher war allerdings die Einteilung in formae speciales (f. sp.) (Eriksson, 1894; Tollenaar, 1967). Die wichtigsten sind (siehe auch Wellings 2011):
- P. striiformis f. sp. tritici Eriks. & Henn.: Hauptwirt Weizen
- P. striiformis f. sp. hordei Eriks. & Henn.: Hauptwirt Gerste
- P. striiformis f. sp. secale Eriksson: Hauptwirt Roggen
- P. striiformis f. sp. dactylidis Tollenaar: Hauptwirt Knaulgras
- P. striiformis f. sp. poae Tollenaar & Houston: Hauptwirt Wiesenrispe
Innerhalb der formae speciales gibt es zudem physiologische Rassen, die nur einzelne Sorten einer bestimmten Art befallen können.
In Europa parasitieren die Gelbrostrassen des Getreides nur selten auch Wiesengräser (Hassebrauck, 1965; Manners, 1960). In Oregon und Kalifornien (USA) wächst die f. sp. tritici hingegen während des Sommers auf Wildgräsern, um dann im Herbst auf Winterweizen zu wechseln (Schaner und Powelson, 1973; Tollenaar, 1967).
Resistenzgene und Gelbrostrassen
Weizensorten unterscheiden sich in ihrer Anfälligkeit für Gelbrost. Sie tragen ein oder mehrere Resistenzgene. Diese können von bestimmten Gelbrostrassen überwunden werden (die Rostrasse ist virulent), was zu einer Infektion und zur Bildung von Uredosporen führt. Pflanzen die Resistenzgene enthalten, welche von dieser bestimmten Rasse nicht überwunden werden können (die Rostrasse ist avirulent), bleiben gesund.
Bisher wurden verschiedene Gelbrostresistenzgene (Yr) mit jeweils mehreren Allelen identifiziert. Die meisten dieser Gene bewirken eine Resistenz gegen spezifische Gelbrostrassen. Diese rassenspezifischen Resistenzen werden auch als vertikale oder qualitative Resistenz bezeichnet und führen in der Regel zu einer Hypersensitivitätsreaktion, die zum raschen Tod der befallenen Pflanzenzellen führt.
In der Pflanzenzüchtung versucht man, möglichst breit wirksame Resistenzgene in einer Weizensorte zu vereinen, um diese gegen möglichst viele Rostrassen dauerhaft resistent zu machen. Die Resistenzzüchtung erleidet jedoch immer wieder Rückschläge, da neue Rostrassen entstehen oder neue Rassen in ein zuvor nicht besiedeltes Gebiet einwandern können.
Es gibt zahlreiche Beispiele für das Auftreten neuer Gelbrostrassen, die regional oder weltweit Epidemien verursacht haben. In den 1970er Jahren verursachte ein Gelbroststamm, der Weizen mit dem Resistenzgen Yr2 befallen konnte, grosse Verluste. In den 1990er Jahren verbreitete sich eine Rasse, die Weizen mit dem Resistenzgen Yr9 infizieren konnte. Ein jüngeres Beispiel ist eine Gelbrostrasse, die Yr27 überwindet und sich epidemisch in Nord- und Westafrika sowie im Mittleren Osten verbreitet.
Vorbeugende Massnahmen und Bekämpfung
- Eine Stoppelbearbeitung und die Beseitigung von Ausfallgetreide vor dem Auflaufen der Herbstsaaten haben eine gute vorbeugende Wirkung.
- Die Verwendung resistenter Sorten ist die beste Massnahme, um einen Befall des Weizens durch den Gelbrost zu verhindern (Schweiz: Liste der empfohlenen Getreidesorten; Deutschland: Sortenliste des Bundessortenamtes; Österreich: Österreichische beschreibende Sortenliste).
- In einer Region sollten Sorten mit verschiedenen Resistenzgenen angebaut werden.
- Eine direkte Bekämpfung mit chemischen Pflanzenschutzmitteln ist möglich. In der Schweiz sind Betriebe, die gemäss dem ökologischen Leistungsnachweis (ÖLN) wirtschaften, verpflichtet, Pflanzenschutzmittel nur gemäss dem Schadschwellenprinzip anzuwenden. Schadschwellen beziehungsweise Bekämpfungsschwellen geben einen Anhaltspunkt, ab welcher Dichte eine Bekämpfung mit Pflanzenschutzmitteln erfolgen soll und wirtschaftlich sinnvoll ist.
Die Bekämpfungsschwelle für Gelbrost an Weizen und Triticale wird in der Schweiz wie folgt bestimmt (Agridea, Datenblätter Ackerbau): Während der Entwicklungsstadien 31 (erster Knoten wahrnehmbar) bis 61 (Beginn der Blüte) werden 40 Halme über die Felddiagonale eingesammelt und die drei obersten, vollentwickelten Blätter pro Halm auf Befall kontrolliert. Die Anzahl befallene Blätter (von total 120) wird gezählt. Die Bekämpfungsschwelle ist erreicht, wenn 3-5 Blätter (3-5 %) mit Gelbrost befallen sind oder ein erster Befallsherd sichtbar ist. - Empfohlene und zugelassene Pflanzenschutzmittel gegen den Gelbrost finden Sie für die Schweiz im BLW Pflanzenschutzmittelverzeichnis (Bundesamt für Landwirtschaft); für Deutschland in der online Datenbank des BVL (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) und für Österreich im Pflanzenschutzmittelregister des BAES (Bundesamt für Ernährungssicherheit).
Literatur
Eriksson J, 1894. On the specialization of parasitism by cereal rust fungi. Ber. Deut. Bot. Ges. 12: 292-331.
Gäumann E, 1959. Beiträge zur Kryptogamenflora der Schweiz (Band XII): Die Rostpilze Mitteleuropas, Büchler und Co. 1407 S.
Häni FJ, Popow G, Reinhard H, Schwarz A, Voegeli U, 2008. Pflanzenschutz im nachhaltigen Ackerbau. Edition LMZ, 7. Auflage. 466 S.
Hassebrauck K, 1965. Nomenklatur, geographische Verbreitung und Wirtsbereich des Gelbrostes, Puccinia striiformis Wet. – Mitt. Biol. Bundesanstalt Land und Forstwirtschaft. Berlin-Dahlem 116: 75 S.
Jin Y, Szabo LJ, Carson M, 2010. Century-old mystery of Puccinia striiformis Life History solved with the identification of Berberis as an alternate host. Phytopathology 100: 432-435.
Manners JG, 1960. Puccinia striiformis Westend. var. dactylidis var. nov. Transactions of the British Mycological Society, Vol. 43 (1): 65-68.
Obst A, Paul V, 1993. Krankheiten und Schädlinge des Getreides. Verlag Th. Mann: 184 S.
Rapilly F, 1979. Yellow rust epidemiology. Ann. Rev. Phytopathology 17: 59-73.
Tollenaar H, 1967. A comparison of Puccinia striiformis f. sp. poae on bluegrass with f.sp. tritici and f. sp. dactylidis. Phytopathology 57: 418-420.
Schaner G, Powelson RL, 1973. The oversummering and dispersal of inoculum of Puccinia striiformis in Oregon. Phytopathology 63: 13-17.
Wellings CR, 2011. Global status of stripe rust: a review of historical and current threats. Euphytica 179: 129-141.



