Roggenbraunrost
rouille brune (franz.), leaf rust of rye or brown rust (engl.)
Wissenschaftlicher Name: Puccinia recondita Rob. ex Desm. f. sp. secalis
Synonym: P. dispersa Erikss. et Henn.
Taxonomie: Fungi, Basidiomycota, Pucciniomycetes, Incertae sedis, Pucciniales, Pucciniaceae
Der Roggenbraunrost (Puccinia recondita f. sp. secalis) kommt in allen Roggenanbaugebieten weltweit vor und zählt dort meist zu den wichtigen Schaderregern. Es handelt sich um einen wirtswechselnden Rostpilz mit vollständigem Entwicklungsgang. Als Zwischenwirt dienen die Ochsenzunge (Anchusa sp.), der Natternkopf (Echium sp.) und andere Vertreter der Raublattgewächse. Ein starker Befall beeinträchtigt den Ertrag und die Qualität des Getreides. Die wichtigsten vorbeugenden Massnahmen zur Verhinderung eines Braunrostbefalls sind: Anbau von resistenten, frühreifen Roggensorten, Winterroggen nicht zu früh säen, Ausfallroggen und Stoppeln vor dem Auflaufen der Herbstsaat vernichten.


 Abb. 1. Roggenbraunrost (Puccinia recondita f.sp. secalis): Uredolager vorwiegend auf der Blattoberseite
Abb. 1. Roggenbraunrost (Puccinia recondita f.sp. secalis): Uredolager vorwiegend auf der Blattoberseite
 Abb. 2. Roggenbraunrost (Puccinia recondita f. sp. secalis): Teleutolager auf der Blattunterseite
Abb. 2. Roggenbraunrost (Puccinia recondita f. sp. secalis): Teleutolager auf der Blattunterseite
Bemerkungen zur Taxonomie
Der Braunrost an Roggen (Secale cereale) wurde erstmals im Jahr 1894 von Eriksson und Henning erwähnt und als Puccinia dispersa Erikss. et Henn. beschrieben. Aufgrund seiner Ähnlichkeit zum Weizenbraunrost wurde er 1966 von Wilson und Henderson der Sammelart Puccinia recondita Rob. ex Desm. zugeordnet. Innerhalb dieser Artengruppe gab es grosse Unterschiede zwischen den Populationen sowohl in der Morphologie als auch im Wirtspflanzenspektrum. Je nach Wirtspflanzen des Dikaryonten (Hauptwirte) und des dazugehörenden Haplonten (Zwischenwirte) wurden zahlreiche formae speciales (f. sp.) beschrieben. So wurde der Braunrost des Weizens zur P. recondita f. sp. tritici und der Braunrost des Roggens zur f. sp. secalis. Der Weizenbraunrost wird heute gemäss geltender Regel als eine eigene Art angesehen und P. triticina Eriks. genannt.
Schadbild
Erste Rostpusteln können bereits im Herbst oder Winter an Roggen beobachtet werden. Meist erscheinen sie jedoch erst ab Mitte Mai, vorwiegend an der Oberseite der Blätter (Abb. 1). Die rostbraunen Uredolager (Sommersporenlager) sind über die ganze Blattfläche verteilt (nicht in Reihen oder Streifen wie beim Gelbrost, P. striiformis). Selten wachsen sie auch an den Blattscheiden und Ähren. Die Lager sind länglich-oval. Im Unterschied zum Schwarzrost (P. graminis) bleiben weniger Epidermisreste am Rande der Lager hängen. Stark befallene Blätter sterben vorzeitig ab.
Gegen Ende der Vegetationsperiode bildet der obligate Parasit an der Blattunterseite, selten auch an der Blattscheide, Teleutosporenlager (Wintersporenlager). Diese sind schwarz, länglich und bleiben von der Epidermis bedeckt (Abb. 2).
Krankheitserreger
Die Uredosporen (Abb. 3) sind kugelig bis ellipsoidisch und im Mittel 23.2 µm lang und 20.4 µm breit (Gäumann 1959). Sie besitzen 8-10 gleichmässig verteilte Keimporen und sind mit Stachelwarzen versehen. Die Uredosporen sind orangebraun (nicht hyalin wie bei P. striiformis). In den Uredolagern befinden sich keine Paraphysen.
Die braunen bis schwarzen Teleutosporen sind zweizellig (Abb. 4), länglich keulenförmig (45.9 µm lang und 16.3 µm breit) und oft abgestumpft oder schräg gestutzt. Die untere Zelle ist meist schmäler und länger als die obere. Die Keimporen sind nicht sichtbar. Der Stiel ist kurz. Bräunliche Paraphysen unterteilen die grossen Lager in kleinere Lager.
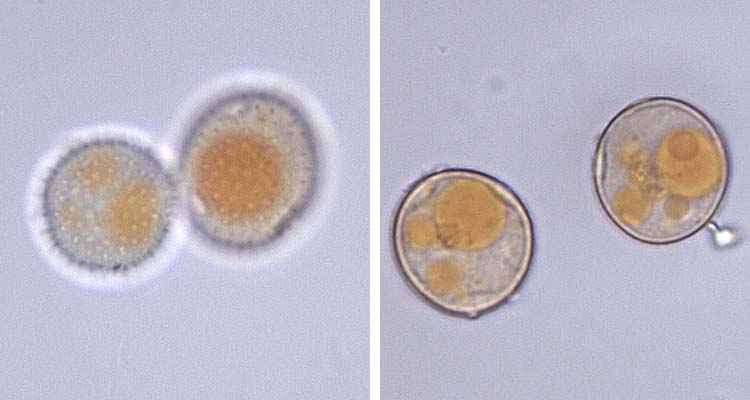 Abb. 3. Roggenbraunrost (Puccinia recondita f.sp. secalis): Uredosporen mit Stachelwarzen und Keimpore
Abb. 3. Roggenbraunrost (Puccinia recondita f.sp. secalis): Uredosporen mit Stachelwarzen und Keimpore
 Abb. 4. Roggenbraunrost (Puccinia recondita f. sp. secalis): Teleutosporen
Abb. 4. Roggenbraunrost (Puccinia recondita f. sp. secalis): Teleutosporen
Lebenszyklus
Roggenbraunrost ist ein wirtswechselnder (heterözischer) Rostpilz mit vollständigem (makrozyklischem) Entwicklungszyklus. Er bildet auf den Blättern in Uredolagern dikaryotische Uredosporen (besitzen zwei haploide Zellkerne). Diese infizieren wiederum den Roggen. Unter günstigen Witterungsbedingungen kommt es zu einer epidemieartigen Ausbreitung des Pilzes. Mit zunehmender Reife des Roggens werden in Teleutolagern an der Blattunterseite Teleutosporen gebildet. Diese sind vorerst ebenfalls dikaryotisch. Die beiden haploiden Zellkerne verschmelzen jedoch bald darauf zu einem diploiden Zellkern (Karyogamie).
Teleutosporen sind Dauersporen, die den Sommer und Winter überdauern können. In gemässigten Klimazonen ist der Braunrost nicht auf einen Zwischenwirt angewiesen. Er überdauert den Winter hier meist als Myzel oder Uredospore auf Ausfall- und/oder Winterroggen.
Vollständiger Entwicklungszyklus: Im Herbst oder im Frühjahr keimt eine oder beide Zellen der Teleutospore mit einem Promyzel. Der diploide Zellkern teilt sich in einer Meiose in vier haploide Zellkerne. Diese wandern in das Promyzel, welches sich anschliessend mittels Septen in vier Zellen mit je einem haploiden Zellkern unterteilt (Basidie). Die haploiden Zellkerne wandern anschliessend durch die Sterigmen in die neu entstehenden Basidiosporen. Diese werden abgestossen und gelangen mit der Luftströmung auf den Zwischenwirt, beispielsweise die Ochsenzunge (Anchusa sp.), den Natternkopf (Echium sp.) oder andere Vertreter der Raublattgewächse. Auf dem Zwischenwirt keimen die Basidiosporen und dringen direkt in das Blatt ein. Es kommt zur Bildung von flaschenförmigen Spermogonien (Pyknidien), in denen Spermatien (früher als Pyknosporen bezeichnet) und Empfängnishyphen gebildet werden. Regentropfen, Tau oder Insekten, die durch einen von den Spermogonien ausgeschiedenen „Nektar" angelockt werden, übertragen die Spermatien auf sexuell kompatible Empfängnishyphen. Nach der Befruchtung entwickeln sich auf der Blattunterseite Aecidien, in denen in Ketten angeordnete, dikaryotische Aecidiosporen wachsen. Auf der Ochsenzunge (Anchusa sp.) können Aecidien vom Frühling bis zum Herbst beobachtet werden. Die Aecidiosporen infizieren den Hauptwirt (Roggen), auf dem wieder Uredosporen gebildet werden..
Infektionsvorgang
Uredosporen können mit dem Wind über mehrere Kilometer verbreitet werden. Gelangt eine virulente Uredospore auf ein anfälliges Roggenblatt und ist dort ein Wasserfilm vorhanden (beispielsweise durch Regen oder Tau), beginnt die Spore zu keimen. Der Keimschlauch wächst auf der Blattoberfläche senkrecht zur Längsachse der Epidermiszellen bis er auf eine Spaltöffnung (Stoma) trifft. Dort bildet sich ein Appressorium. Eine Penetrationshyphe dringt durch die geschlossene Spaltöffnung in die Pflanze ein und entwickelt ein substomatäres Vesikel. Aus diesem entsteht die Infektionshyphe, die so lange wächst bis sie auf eine Mesophyllzelle trifft. An ihrer Spitze wird eine Haustorienmutterzelle abgeschnürt. Ausgehend von dieser Zelle durchwächst der Pilz die pflanzliche Zellwand und bildet in der Pflanzenzelle ein Haustorium. Bei der Bildung des Haustoriums wird das Plasmalemma der Wirtszelle eingestülpt und umschließt das Haustorium als extrahaustoriale Membran, so dass dieses nicht direkt mit dem Cytoplasma in Kontakt steht. Das Haustorium ist eine spezialisierte pilzliche Hyphe, die der Nährstoffversorgung des Pilzes dient, ohne die Wirtszelle dabei abzutöten. Von der Infektionshyphe aus entstehen weitere Haustorienmutterzellen, die wiederum Haustorien in benachbarte Mesophyllzellen senden.
Sieben bis zehn Tage nach Beginn der Infektion entstehen Sporenmutterzellen, welche die ersten Uredosporen abschnüren. In der Folge bricht die Epidermis auf, so dass die Sporen vom Wind fortgetragen werden können. Auf sehr anfälligen Roggenpflanzen werden rund um das primäre Uredolager noch weitere sekundäre Sporenlager gebildet. Selbst 16 Tage nach dem Eindringen des Pilzes in die Pflanze sind als Folge der Infektion erst wenige Pflanzenzellen abgestorben.
Resistenzreaktion: Wenn eine avirulente Uredospore auf eine resistente Roggenpflanze gelangt, dringt sie, wie oben beschrieben, in das Blatt ein. Die Entwicklung des Haustoriums wird jedoch verhindert, da die Pflanzenzelle eine hypersensitive Resistenzreaktion auslöst, durch die sie sich selbst tötet.
Braunrostrassen
Die verschiedenen Rassen unterscheiden sich in ihrer Fähigkeit, bestimmte Roggensorten zu befallen oder eben nicht zu befallen. Spezifische Gene des Rostpilzes bestimmen seine Virulenz bzw. Avirulenz. Die Interaktion dieser Gene mit den Resistenzgenen der Wirtspflanze bestimmt den Infektionstyp auf einer Sorte. Neue Braunrostrassen entstehen auf dem Zwischenwirt durch Genrekombination oder durch natürlich vorkommende zufällige Mutationen in den Uredosporen. Oft kommt es vor, dass Rostrassen in ein Gebiet einfliegen oder eingeschleppt werden, wo sie bis anhin nicht auftraten. Dies kann bei den Rostpilzen über sehr grosse Distanzen hinweg stattfinden.
Über die vorkommenden Rassen in den Braunrostpopulationen von Roggen ist noch sehr wenig bekannt. Klocke (2004) und Miedaner et al. (2012) untersuchten die Virulenzstruktur und -dynamik der deutschen Roggenbraunrostpopulationen. Sie konnten zwischen schwach bis hoch virulenten Isolaten unterscheiden.
Epidemiologie
Roggenbraunrost kann sich in einem weiten Temperaturbereich vermehren. Im Vergleich zum Weizenbraunrost ist er jedoch besser an niedrigere als an höhere Temperaturen angepasst (Obst und Paul 1993). Er entwickelt sich bei Tagestemperaturen von 20-26 °C und kühlen Nächten (nicht unter 12 °C) mit starker Taubildung besonders gut. Eine intensive Lichteinstrahlung fördert die Sporenbildung zusätzlich.
Der Anbau anfälliger Sorten, eine hohe Stickstoffversorgung, mildes Herbst- und Winterwetter sowie ein warmes Frühjahr begünstigen den Braunrost und ermöglichen eine rasche Vermehrung des Rostpilzes. Ein Braunrostbefall im Vorjahr erhöht die Gefahr eines erneuten Befalls. Die Krankheit erscheint meistens relativ spät und verursacht deshalb nur selten einen ins Gewicht fallenden Ertragsausfall, ausser bei spät reifenden Sorten.
Myzel und Uredosporen überleben tiefe Temperaturen problemlos, so dass der Rostpilz auch ohne Zwischenwirt in einer Region überleben kann.
Wirtsspektrum
Hauptwirt des Roggenbraunrost, P. recondita f. sp. secalis, ist ausschliesslich Kulturroggen.
Zwischenwirte der P. recondita f. sp. secalis sind Ochsenzunge (Anchusa sp.), der Natternkopf (Echium sp.) und andere Vertreter der Raublattgewächse.
Roggensorten unterscheiden sich in ihrer Anfälligkeit gegenüber Braunrost. Sie tragen ein oder mehrere Resistenzgene. Diese können von bestimmten Braunrostrassen überwunden werden (= Rostrasse ist virulent), was zu einer Infektion und zur Bildung von Uredosporen führt. Pflanzen, die Resistenzgene enthalten, welche von dieser bestimmten Rasse nicht überwunden werden können (die Rasse ist avirulent), bleiben gesund. Wehling et al. (2003) und Roux et al. (2004) identifizierten fünf verschiedene Resistenzgene auf vier Roggenchromosomen: Pr1 auf dem Chromosom 6RL, Pr2 auf 7RL, Pr3 auf 1RS, sowie Pr4 und Pr5 auf 1RL. Jedes dieser fünf Gene bewirkt eine Resistenz gegen viele Einpustel-Isolate des Roggenbraunrosts. Zudem konnten zwischen den Pr Genen Unterschiede in der Anfälligkeit gegen die verschiedenen Isolate beobachtet werden.
Der Pflanzenzüchter versucht, möglichst breit wirksame Resistenzgene in einer Roggensorte zu vereinen, um diese gegen möglichst viele Rostrassen dauerhaft resistent zu machen. Die Resistenzzüchtung erleidet jedoch immer wieder Rückschläge, da neue Rostrassen entstehen oder neue Rassen in ein zuvor nicht besiedeltes Gebiet einwandern können. Deshalb wird weiterhin in Landrassen, bei verwandten Arten sowie Wild- und Urformen des Roggens nach neuen Resistenzgenen gesucht. Diese sind jedoch meist mit Genen für negative agronomische Eigenschaften gekoppelt, so dass sie nicht genutzt werden können.
Vorbeugende Massnahmen und Bekämpfung
- Die wichtigste Massnahme, um Ertragseinbussen durch Braunrost zu vermeiden, ist die Wahl resistenter, frühreifer Roggensorten. Die Anfälligkeit der Sorten für Braunrost ist für die Schweiz in der Liste der empfohlenen Getreidesorten, für Deutschland in der Sortenliste des Bundessortenamtes und für Österreich in der Österreichischen beschreibenden Sortenliste angegeben.
- Winterroggen nicht zu früh säen, um Herbstinfektionen zu vermeiden (Häni et al. 2008)
- Um den Lebenszyklus des Braunrostes zu unterbrechen, ist es sinnvoll, Ausfallroggen und Stoppeln vor dem Auflaufen der Herbstsaat zu vernichten.
- Gut mit Stickstoff versorgter Roggen ist anfälliger für Braunrost. Deshalb soll der Stickstoff zurückhaltend eingesetzt und die Einzelgaben nicht zu hoch dosiert werden.
- Braunrost tritt relativ spät auf, weshalb meist keine chemische Bekämpfung nötig ist. In der Schweiz ist die Bekämpfungsschwelle erreicht, wenn während der Entwicklungsstadien 37 (Erscheinen des Fahnenblattes) bis 61 (Beginn Blüte) bei anfälligen Sorten ein Befall von 1 bis 4 %, beziehungsweise bei weniger anfälligen Sorten ein Befall von 10 % der Blätter vorhanden ist (Agridea, Datenblätter Ackerbau).
- Empfohlene und zugelassene Pflanzenschutzmittel zum Schutz gegen den Roggenbraunrost finden Sie für die Schweiz im BLW Pflanzenschutzmittelverzeichnis (Bundesamt für Landwirtschaft); für Deutschland in der online Datenbank des BVL (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) und für Österreich im Pflanzenschutzmittelregister des BAES (Bundesamt für Ernährungssicherheit).
Literatur
Anikster Y, Bushnell WR, Eilam T, Manisterski J, Roelfs AP, 1997. Puccinia recondita causing leaf rust on cultivated wheats, wild wheats and rye. Can. J. Bot. 75: 2082-2096.
Gäumann E, 1959. Beiträge zur Kryptogamenflora der Schweiz (Band XII): Die Rostpilze Mitteleuropas, Büchler und Co. 1407 S.
Häni FJ, Popow G, Reinhard H, Schwarz A, Voegeli U, 2008. Pflanzenschutz im nachhaltigen Ackerbau. Edition LMZ, 7. Auflage. 466 S.
Klocke B, 2004. Virulenzstruktur und –dynamik des Roggenbraunrostes (Puccinia recondita f.sp. secalis in der Bundesrepublik Deutschland. Dissertation Martin-Luther Universität Halle-Wittenberg: 141 S.
Miedaner T, Klocke B, Flath K, Geiger HH, Weber WE, 2012. Diversity, spatial variation, and temporal dynamics of virulences in the German leaf rust (Puccinia recondita f.sp. secalis) population in winter rye. European Journal of Plant Pathology 132: 23-35
Obst A, Paul V, 1993. Krankheiten und Schädlinge des Getreides. Verlag Th. Mann: 184 S.
Roux SR, Hackauf B, Linz A, Ruge B, Klocke B, Wehling P, 2004. Leaf-rust resistance in rye (Secale cereale L.). 2. Genetic analysis and mapping of resistance genes Pr3, Pr4, and Pr5. Theor. Appl. Genet., Band: 110: 192-201
Wehling P, Linz A, Hackauf B, Roux SR, Ruge B, Klocke B, 2003. Leaf-rust resistance in rye (Secale cereale L.). 1. Genetic analysis and mapping of resistance genes Pr1 and Pr2. Theor. Appl. Genet., Band: 107, Heft: 3: 432-438



