Stängel- und Kolbenfäule an Mais
fusariose du maïs (franz.); fusarium stalk rot, ear rot of maize (engl.)
Verursacher der Stängel- und Kolbenfäule an Mais sind pilzliche Erreger der Gattung Fusarium:
- Fusarium graminearum Schwabe; Hauptfruchtform (Teleomorph): Gibberella zeae (Schweinitz) Petch
- F. culmorum (W. G. Smith) Sacc.; Hauptfruchtform unbekannt
- F. verticillioides (Sacc.) Nirenberg (Synonym = F. moniliforme Sheld.); Hauptfruchtform: G. moniliformis Wineland (= G. fujikuroi (Sawada) Wollenw.)
- F. subglutinans (Wollenw. & Reinking) Nelson, Toussoun & Marasas; Hauptfruchtform: G. subglutinans Nelson, Toussoun & Marsas (Syn.: G. fujikuroi var. subglutinans Edwards
- F. proliferatum (Matsush.) Nirenberg; Hauptfruchtform: G. intermedia (Kuhlmann) Samuels, Nirenberg & Seifert
- F. crookwellense L.W. Burgess, Nelson & Toussoun; Hauptfruchtform unbekannt
- F. sporotrichioides Sherb.; Hauptfruchtform unbekannt
- F. equiseti (Corda.) Sacc.; Hauptfruchtform: Gibberella intricans Wollenw.
- und andere Fusarium Arten
Taxonomie (Beispiel F. graminearum): Fungi, Ascomycota, Pezizomycotina, Sordariomycetidae, Hypocreomycetidae, Hypocreales, Nectriaceae, Gibberella
Fusarien Pilze kommen in allen Böden vor. Sie spielen eine wichtige Rolle beim Abbau von abgestorbenen Pflanzenresten. Einige Arten können Pflanzenkrankheiten verursachen, unter anderem auch an Mais. Fusarium graminearum und F. verticillioides waren in einer Studie von Dorn et al. (2009) in der Nordschweiz die wichtigsten Erreger der Kolbenfäule an Mais. Die vorherrschenden Arten an den Maisstängeln waren F. equiseti und F. verticillioides. Fusarien können Wurzeln, Stängel und Maiskolben befallen. Sie verursachen Ernteverluste und bilden Mykotoxine (zum Beispiel Deoxynivalenol =DON), welche die Gesundheit von Mensch und Tier gefährden. Ein hoher Anteil von Mais in der Fruchtfolge, insbesondere bei Direktsaat, ist der grösste Risikofaktor für das Auftreten der Stängel- und Kolbenfäule. Eine Reduktion des Befalls kann dabei bereits mit einer sorgfältigen Einarbeitung der befallenen Stoppelreste erreicht werden.
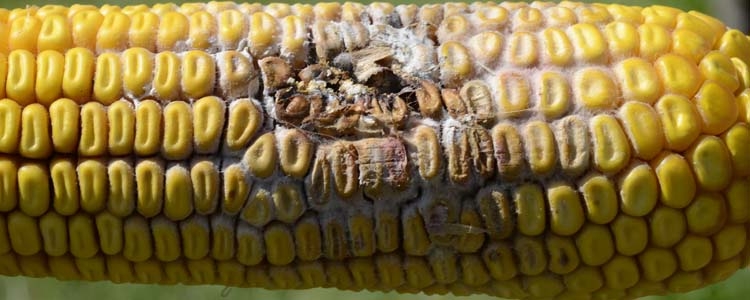
 Abb. 1. Kolbenfäule an Mais, verursacht durch Fusarien (F. graminearum): Rosarotes Myzel an den Lieschen und den Körnern ist deutlich sichtbar.
Abb. 1. Kolbenfäule an Mais, verursacht durch Fusarien (F. graminearum): Rosarotes Myzel an den Lieschen und den Körnern ist deutlich sichtbar.
Krankheitsbild
Keimlingsfäule: Fusarien können (zusammen mit anderen pilzlichen Erregern) Auflaufkrankheiten verursachen. Wurzeln und Stängelbasis sind bräunlich verfärbt. Bei starkem Befall stirbt der Keimling. Dies führt zu lückigen Beständen und Ertragsausfällen.
Wurzel- und Stängelfäule: Im Laufe des Sommers befallen verschiedene bodenbürtige Pilze die Wurzeln und verursachen schwarze Flecken. Später ist das gesamte Wurzelwerk geschädigt und die Fäule dehnt sich oft auf den Stängel aus. Die Maisstängel werden vorwiegend an den Knoten befallen. Diese werden braun und weich. Die Stängelbasis ist vermorscht und das Markgewebe von einem weissen oder rötlichen Myzel durchzogen (Hurle et al. 2005) . Dies führt zu Stängelbruch und zur Notreife. Kranke Pflanzen im Bestand erkennt man an den zunächst blaugrünen, dann braunen Blättern, an gelben Stängeln und herabhängenden Kolben mit vorzeitig dürren Lieschen.
Kolbenfäule: Einzelne Körner oder ganze Maiskolben sind mit weissem bis rosarotem Pilzgeflecht (Myzel) überwachsen (Abb. 1). Bei starkem Befall sind auch die Lieschen rötlich verfärbt und durch das Pilzgeflecht verklebt. Die Fäulnis zeigt sich auch an der Spindel und am Kolbenansatz. Derart befallener Mais sollte nicht verfüttert werden, da die enthaltenen Mykotoxine zu Gesundheitsstörungen führen können.
Krankheitserreger
Die verschiedenen, an Mais vorkommenden Fusarium-Arten bilden charakteristische Konidien und Fruchtkörper. Diese lassen sich mikroskopisch voneinander unterscheiden:
- Fusarium graminearum: Die Makrokonidien (Abb. 2) sind hyalin, gerade oder sichelförmig gekrümmt, drei- bis siebenfach septiert und messen 30-60 µm x 4-6 µm (White 1999). Die Krümmung ist bei den zugespitzten Endzellen ausgeprägt. Die Fusszellen sind verlängert, leicht gebogen und spitz zulaufend („Füsschen"). Kugelförmige Chlamydosporen werden oft erst sehr spät und nur von wenigen Isolaten gebildet. F. graminearum bildet keine Mikrokonidien. Die Hauptfruchtform (Gibberella zeae) bildet Perithecien (Abb. 3) mit Asci und Ascosporen. Die schwarzen, eiförmigen Perithecien wachsen oberflächlich, meist in Gruppen und messen 150-350 µm im Durchmesser (Bockus et al. 2010). Asci sind keulenförmig, 8-11 x 60-85 µm gross und enthalten 8 Ascosporen (Abb. 4). Letztere sind hellbraun, dreifach septiert, leicht gebogen, an den Enden abgerundet und messen 20-25 µm x 3-4 µm (Abb. 5).
- F. culmorum: Die Makrokonidien sind leicht gebogen, 3 bis 5 fach septiert und messen 25-50 µm x 4-7 µm (dicker als F. graminearum) (Wiese 1977). Die Endzellen sind zugespitzt, die Fusszellen bilden deutliche, charakteristische „Füsschen". Dickwandige, kugelförmige Chlamydosporen (Durchmesser 9-14 µm) sind häufig. F.culmorum bildet keine Mikrokonidien und keine Hauptfruchtform.
- F. verticillioides (Synonym = F. moniliforme) bildet relativ lange, schlanke, sichelförmige 3-5 fach septierte Makrokonidien und nicht septierte Mikrokonidien, aber keine Chlamydosporen. Hauptfruchtform: G. moniliformis (= G. fujikuroi)
- F. subglutinans bildet schlanke, gerade, 3 bis 5 fach septierte Makrokonidien und nicht septierte Mikrokonidien, aber keine Chlamydosporen. Hauptfruchtform: G. subglutinans (= G. fujikuroi var. subglutinans)
- F. proliferatum bildet wenige, schlanke, sichelförmige, 3-fach septierte Makrokonidien und nicht septierte Mikrokonidien, aber keine Chlamydosporen. Hauptfruchtform G. intermedia
- F. crookwellense bildet relativ breite, 5-fach septierte Makrokonidien, deren Rücken stärker gebogen ist als die Bauchseite. Keine Mikrokonidien, Chlamydosporen sind vorhanden. Hauptfruchtform nicht bekannt.
- F. sporotrichioides bildet sichelförmige, 3 (bis 5) fach septierte Makrokonidien und nicht septierte, birnförmige Mikrokonidien, Chlamydosporen vorhanden. Hauptfruchtform nicht bekannt.
- F. equiseti: Die langen bis sehr langen Makrokonidien sind 22-60 µm x 3.5-6 µm gross und haben vier bis sieben deutlich sichtbare Septen. Endzellen sind deutlich gebogen und Fusszelle bildet charakteristisches „Füsschen". Mikrokonidien werden keine gebildet. Die Hauptfruchtform heisst Gibberella intricans, sie kann aber nur sehr selten beobachtet werden.
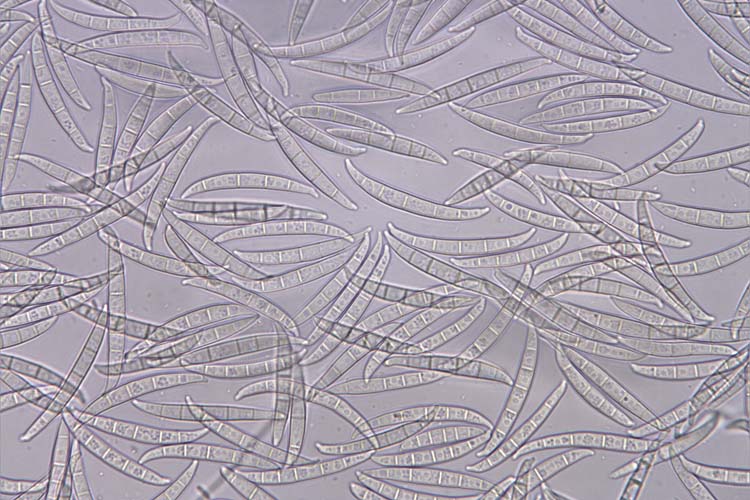 Abb. 2. Makrokonidien der Fusarium graminearum
Abb. 2. Makrokonidien der Fusarium graminearum


 Abb. 3. Ein mit Fusarien befallener Maiskolben (Kolben von Abb. 1) nach der Überwinterung im Freien. Die schwarzen, kugeligen Fruchtkörper an den Lieschen und Körnern sind Perithecien der Hauptfruchtform Gibberella zeae. In den Perithecien befinden sich Asci mit je 8 Ascosporen (siehe Abb. 4).
Abb. 3. Ein mit Fusarien befallener Maiskolben (Kolben von Abb. 1) nach der Überwinterung im Freien. Die schwarzen, kugeligen Fruchtkörper an den Lieschen und Körnern sind Perithecien der Hauptfruchtform Gibberella zeae. In den Perithecien befinden sich Asci mit je 8 Ascosporen (siehe Abb. 4).
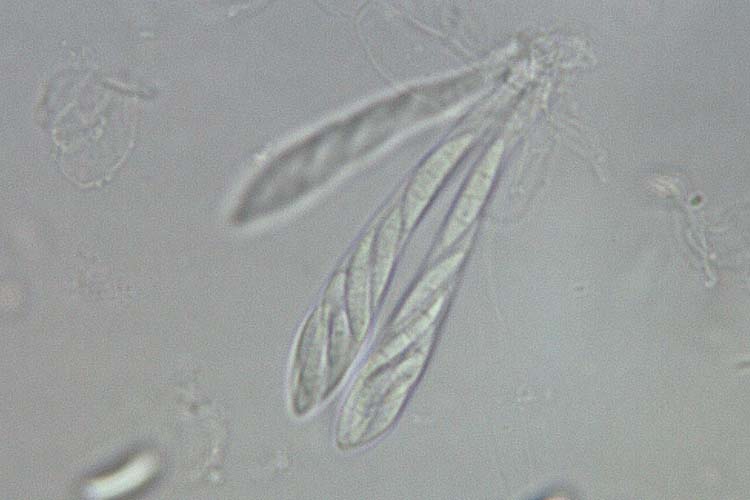 Abb. 4. Asci mit Ascosporen der Gibberella zeae (anamorph F. graminearum)
Abb. 4. Asci mit Ascosporen der Gibberella zeae (anamorph F. graminearum)
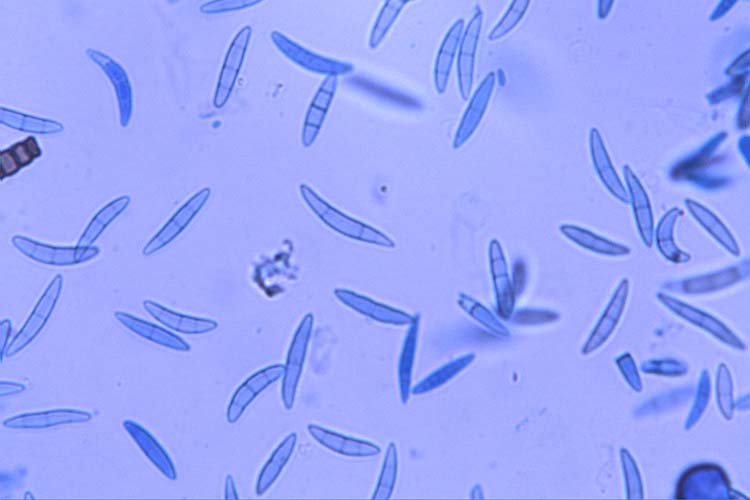 Abb. 5. Ascosporen der Gibberella zeae (anamorph F. graminearum)
Abb. 5. Ascosporen der Gibberella zeae (anamorph F. graminearum)
Lebenszyklen der Fusarien an Mais
Fusarien-Pilze überwintern an Saatgut oder an befallenen Pflanzenresten (besonders wichtig sind Maisstoppeln) im und auf dem Boden. Einige Fusarienarten haben die Möglichkeit in Form von Dauersporen (Chlamydosporen) zu überdauern.
F. graminearum und andere Fusariu-Arten bilden an befallenen Pflanzenresten (zum Beispiel Maisstoppeln) nach einer Überwinterung die Hauptfruchtform in Form von kleinen kugeligen Fruchtkörpern (Perithecien). In den Perithezien (Abb. 3) wachsen Asci mit Ascosporen. Letztere werden aus den Asci entlassen und durch Wind, Regen oder Insekten verbreitet.
Die Infektion der Maispflanze erfolgt duch Ascosporen oder Konidien (White 1999) über die Wurzeln oder über Verletzungen an Stängelbasis und Blattansatzstelle (Häni et al. 2008). Der Pilz zerstört in der Folge das Markgewebe zwischen den Leitbündeln. Ein Befall des Stängels wird in der Regel erst nach der Kolbenausbildung sichtbar.
Die Maiskolben werden grundsätzlich auf drei verschiedene Arten infiziert (Mesterhazy et al. 2012):
- Während der weiblichen Blüte landen die Pilzsporen auf den Narbenfäden (Griffel). Die Sporen keimen, wachsen entlang der Fäden zum Kolben und infizieren die Körner und die Spindel.
- Die Fusarien-Sporen dringen durch Verletzungen in den Maiskolben. Verletzungen können durch Maiszünsler, Vögel oder Hagelschlag verursacht worden sein.
- Einige Fusarienarten (z.B. F. verticillioides) wachsen systemisch und können über den infizierten Stängel in den Maiskolben wachsen.
Nach der Blüte wächst der Pilz in der Spindel und den Körnern weiter. Dieses Wachstum und damit die Bildung von Mykotoxinen wird durch lang anhaltende Niederschläge in Verbindung mit einer langen Abreifezeit gefördert.
Da die Ascosporen häufig zum Zeitpunkt der Weizenblüte aus den Asci ausgestosssen werden, können diese auch Weizenblüten infizieren und so eine Ährenfusariose verursachen.
Epidemiologie
Fusarien sind weit verbreitete Bodenbewohner und am Abbau von zellulosehaltigen Pflanzenresten massgeblich beteiligt. Von hier aus können sie junge Maispflanzen befallen und Keimlings- oder Fusskrankheiten erzeugen. Eine Infektion kann auch von infiziertem Saatgut ausgehen.
Die Zunahme der minimalen Bodenbearbeitung und ein Verzicht auf das Pflügen begünstigt ein vermehrtes Aufkommen der Stängel- und Kolbenfäule. Auch enge Getreide - Mais - Fruchtfolgen bei gleichzeitig nicht sorgfältig eingearbeiteten Ernterückständen bilden ein hohes Risiko für eine Infektion.
Die Witterung in der Zeit zwischen Blüte und Ernte hat den grössten Einfluss auf den Fusarienbefall und damit auch auf den Mykotoxingehalt. Besonders gute Voraussetzungen für einen Befall sind bei regenreichen und kühlen Spätsommer- und Herbstwochen gegeben. Eine verzögerte Kolbentrocknung als Folge einer länger anhaltenden feuchten Witterung verstärkt die Kolbenfäule zusätzlich.
Eine Schädigung des Kolbens durch Insekten (Maiszünslerlarven) oder Hagel erhöht das Befallsrisiko.
Früh abreifende Sorten zeigen in der Regel weniger Kolbenfäule und weniger Mykotoxingehalte als spät abreifende (Papst et al. 2007). Spät gesäte Maispflanzen oder spät abreifende Sorten neigen zu vermehrter Infektion durch F. graminearum und damit zu einem erhöhten DON Gehalt (Blandino et al. 2009).
Die Witterung beeinflusst auch die Mykotoxinproduktion. Typ-A Trichothecene werden bei mässig warmen (Optimum zwischen 20-25 °C) und feuchten Bedingungen gebildet. Die optimale Temperatur für Typ-B Trichothecene- und Moniliforminbildung liegt bei 25-28 °C. Im Gegensatz dazu weist die Bildung von Zearalenon eine weites Optimum von 17-28 °C auf. Kühle bis warme Temperaturen von 15-30 °C sind optimal für die Produktion der Fumonisine (Doohan et al. 2003).
Mykotoxine
Mykotoxine sind Naturstoffe, die für Menschen, Tiere und Pflanzen giftig sind. Je nach Fusarium-Art werden unterschiedliche Toxine gebildet (Tabelle 1): Trichothecene. Zearalenon, Moniliformin, Fumonisine und andere. Die Menge an gebildetem Mykotoxin hängt stark vom Pilzstamm und den Umweltbedingungen ab (Garcia et al. 2009).
Die Stoffklasse der Trichothecene werden in zwei Typen unterteilt: Zu den Typ-A Trichothecenen gehören das T-2 und das HT-2 Toxin, zu den Typ-B Trichothecenen das Deoxynivalenol (DON) und das Nivalenol (NIV). Die Typ-A Trichothecene sind im Allgemeinen giftiger als diejenigen des Typs B.
Trichothecene sind sehr stabil und werden durch Verarbeitungsprozesse wie Mahl-, Back- und Brauvorgänge nicht zerstört. Sie verhindern bei Pflanzen und Tieren die Biosynthese von Eiweiss. Das wichtigste Fusarientoxin, das DON, schwächt zudem das Immunsystem des Menschen und verursacht Durchfall und Erbrechen. Schweine reagieren besonders empfindlich auf hohe Toxingehalte im Futter. Gehalte über 10 mg/kg Futter lösen akute Symptome wie Erbrechen (DON wurde früher auch Vomitoxin genannt) und Futterverweigerung aus. Wiederholte Aufnahme von DON führt zu Schädigungen der Schleimhäute im Mund- und Rachenbereich, von Darm, Leber, Niere, Pankreas, Lymphsystem sowie der Immunabwehr (Lepschy 1992, Ueno 1983).
Aufgrund der hohen Giftigkeit der Trichothecene wurden in der Schweiz Grenzwerte für DON festgelegt. Diese werden in der Schweiz in der Verordnung des EDI über die Höchstgehalte für Kontaminanten (Kontaminantenverordnung, VHK) geregelt. Für Futtermittel gibt es Richtwerte als Empfehlung.
Das Mykotoxin Moniliformin wird von F. proliferatum, F. subglutinans und F. equiseti gebildet. Es schädigt die Muskeln. insbesondere den Herzmuskel.
Ein weiteres Fusarientoxin, das Zearalenon, hat eine östrogene Wirkung und wird deshalb oft auch als Phytoöstrogen bezeichnet. Wiederkäuer können das Zearalenon im Pansen abbauen. Bei Schweinen kann es nach Verabreichung von Zearalenon zu einer krankhaften Vergrösserung von Vulva und Uterus kommen, was zu Fruchtbarkeitsstörungen oder Aborten führen kann. F. graminearum, F. equiseti und F. crookwellense sind verantwortlich für die Anreicherung dieses Mykotoxins.
F. verticillioides, F. proliferatum und F. subglutinans bilden Fumonisine B1 bis B4. Diese Gruppe von Mykotoxinen wird vor allem in Mais in hohen Mengen gefunden. Ihnen wird eine kanzerogene Wirkung nachgesagt.
Beauvericin, ebenfalls von F. verticillioides, F. proliferatum und F. subglutinans gebildet, ist eine Substanz mit zellschädigender, antibiotischer und insektizider Eigenschaft.
Enniatine erhöhen die Permeabilität von Zellmembranen für Ionen. Sie werden von F. proliferatum und F. subglutans gebildet.
Tabelle 1: wichtige Fusarium-Arten im Getreideanbau und deren Mykotoxine
|
Fusarium-Arten |
Toxingruppe |
Mykotoxin |
Wirkung |
|
F. equiseti F. sporotrichioides |
Typ A Trichothecen |
T2-Toxin HT2-Toxin |
Magen-Darmtoxin, Immunotoxizität |
|
F. graminearum F. culmorum F. equiseti F. crookwellense |
Typ B Trichothecen |
Deoxynivalenol (DON) Nivalenol |
Magen-Darmtoxin, Erbrechen, Durchfall, Immunotoxizität |
|
F. proliferatum F. subglutinans F. equiseti |
Moniliformin |
Atemnot, Muskelschwäche (Herzmuskel) |
|
|
F. graminearum F. culmorum F. equiseti F. crookwellense |
Östrogen |
Zearalenon |
östrogene Wirkung, verminderte Fruchtbarkeit |
|
F. verticillioides F. proliferatum F. subglutans |
Fumonisine B1 bis B4 |
kanzerogen |
|
|
F. verticillioides F. proliferatum F. subglutans |
Beauvericin |
zellschädigend |
|
|
F. proliferatum F. subglutans |
Enniatine |
zellschädigend |
Wirtsspektrum
Viele Fusarium-Arten, die auf Mais gefunden werden, zählen auch Getreidearten und verschiedene Gräser zu ihren Wirtspflanzen.
Resistenz
Nach Miedaner (2011) gibt es bei Mais ausschliesslich quantitative Resistenzen, die auf vielen Genen beruhen und stark umweltabhängig sind. Die Züchtung von resistenten Maissorten wird durch die Tatsache erschwert, dass viele verschiedene Fusarium-Arten die Maispflanzen befallen können und zudem meistens gemischte Infektionen vorkommen. Eine Resistenz gegen eine bestimmte Fusarium-Art bedeutet aber nicht zwangsläufig auch eine Resistenz gegen eine andere Fusarium-Art (Reid et al. 2009).
Eine Resistenz der Maispflanze gegen Insekten bewirkt einen geringeren Fusarienbefall. Genetisch veränderter Bt-Mais (Mais mit Genen von Bacillus thuringiensis mit insektizider Wirkung) hatte einen signifikant tieferen Mykotoxingehalt, insbesondere DON Gehalt, im Vergleich mit konventionellen Maissorten (Wu et al. 2006).
Vorbeugende Massnahmen und Bekämpfung
- Bodenbearbeitung: Pflügen ist besser als Mulchsaat (Musa et al. 2011), Mulchsaat ist besser als Direktsaat. Mit Fusarien befallene Ernterückstände (Stroh und Stoppeln) der Vorfrucht sind wichtige Infektionsquellen. Deshalb verringern alle Massnahmen, welche die Strohrotte beschleunigen, das Infektionspotenzial: Zerkleinern der Ernterückstände, Stroh mit dem Pflug flach einarbeiten oder vergraben. Eine frühe Ernte ermöglicht eine längere und bei höheren Temperaturen einsetzende Strohrotte.
- Fruchtfolge: Den Anteil von Mais und Getreide in der Fruchtfolge möglichst gering halten. Mais als Vorfrucht fördert den Befall der Folgefrucht Weizen mit Fusarien.
- Sortenwahl (Mais-Sortenliste Schweiz): Informationen hinsichtlich Anfälligkeit für Kolbenfäule der empfohlenen Maissorten stehen in der Schweiz leider nicht zur Verfügung. Früh reifende Sorten zeigen in der Regel weniger Kolbenfäule und weniger Mykotoxingehalte als spät abreifende, allein schon wegen ihres früheren Erntetermins.
- Saat: Eine frühe Aussaat ermöglicht einen früheren Drusch und verringert dadurch das Mykotoxin-Belastungsrisiko.
- Maiszünsler: Über die Bohrkanäle der Maiszünslerlarven können Fusarien in die Maiskolben eindringen. Die Bekämpfung des Maiszünslers mit Schlupfwespen (Trichogramma brassicae) oder anderen Verfahren reduziert daher indirekt auch das Fusarium-Befallsrisiko.
- Ernte: Eine rechtzeitige (frühe) Ernte verkürzt die Wachstumszeit der Fusarienpilze und damit auch des Mykotoxingehalts. Körner nach dem Drusch sofort reinigen und trocknen (weniger als 14 % Kornfeuchte).
Literatur
Blandino M, Reyneri A, Vanara F, 2009. Effect of sowing time on toxigenic fungal infection and mycotoxin contamination of maize kernels. J. Phytopathology 157: 7-14.
Bockus WW, Bowden RL, Hunger RM, Morrill WL, Murray TD, Smiley RW, 2010. Compendium of wheat Diseases and Pests. Third edition. The American Phytopathological Society, St. Paul Minnesota: 171 p.
Doohan F M, Brennan J, Cooke BM, 2003. Influence of climatic factors on Fusarium species pathogenic to cereals. European Journal of Plant Pathology, 109: 755-768.
Dorn B, Forrer HR, Schürch S, Vogelgsang S, 2009. Fusarium-Arten und Mykotoxine auf Mais in der Schweiz. Agrarforschung 16 (7): 232-237.
Garcia D, Ramos AJ, Sanchis V, Marin S, 2009. Predicting mycotoxins in foods: a review. Food Microbiol. 26: 757-769.
Häni FJ, Popow G, Reinhard H, Schwarz A, Voegeli U, 2008. Pflanzenschutz im nachhaltigen Ackerbau. Edition LMZ, 7. Auflage. 466 S.
Hurle K, Mehrtens J, Meinert G, 2005. Mais- Unkräuter, Schädlinge, Krankheiten. DLG Verlag: 144 S.
Lepschy J, 1992. Fusarientoxine in Getreide - ihre Entstehung und Vorbeugungsmass- nahmen. Gesunde Pflanze 44: 35-39.
Mesterhazy A, Lemmens M, Reid LM, 2012. Breeding for resistance to ear rots caused by Fusarium spp. in maize – a review. Plant Breeding 131: 1-19.
Miedaner T, 2011. Resistenzgenetik und Resistenzzüchtung, DLG-Verlags-GmbH, Frankfurt/M., 237 S.
Musa T, Jenny E, Forrer HR, Vogelgsang S, 2011. Fusarien und Mykotoxine bei Körnermais in der Schweiz. Agrarforschung Schweiz 2 (11-12): 520-525.
Papst C., Zellner J, Venkataratnam S, Eder J, 2007. Fusarium – Problematik bei Körnermais (Zea mays L.). Gesunde Pflanzen 59: 7-16.
Reid LM, Zhu CX, Parker CA, Yan CW, 2009. Increased resistance to Ustilago zeae and Fusarium verticillioides in maize inbred lines bred for Fusarium graminearum resistance. Euphytica 165: 567-578.
Ueno, Y, 1983. Trichothecenes - Chemical, Biological and Toxicological Aspects. Tokyo/Amsterdam: Kodansha/Elsevier, 313 S.
Wiese MV, 1977. Compendium of wheat diseases. The American Phytopathological Society, St. Paul Minnesota: 106 S.
White DG (ed.), 1999. Compendium of Corn Diseases, Third Edition. The American Phytopathological Society, APS Press, St. Paul Minnesota: 77 S.
Wu F, 2006. Mycotoxin reduction in Bt corn: potential economic, health and regulatory impacts. Transgenic Res. 15: 277-289.