Septoria-Blattdürre des Weizens
septoriose du blé (franz.); septoria tritici blotch (Stb) of wheat, septoria leaf spot or speckled leaf blotch (engl.)
Wissenschaftliche Name:
Hauptfruchtform (sexuelle Fortpflanzungsform = Teleomorphe): Mycosphaerella graminicola (Fuckel) J. Schroeter
Nebenfruchtform (asexuelle Fortpflanzungsform = Anamorphe): Septoria tritici Roberge ex Desmaz.
Synonyme: Septoria curtisiana Sacc., S. graminum Desm., S. tritici var. lolicola R. Sprague & Aar., Sphaerella graminicola Fuckel
Taxonomie: Fungi, Ascomycota, Dothideomycetes, Dothideomycetidae, Capnodiales, Mycosphaerellaceae
Vor rund 40 Jahren, kam die Septoria-Blattdürre (Septoria tritici) vor allem in den Weizenanbaugebieten des Mittelmeerraums und der „Great Plains" Nordamerikas vor. Die Blatt- und Spelzenbräune (Stagonospora nodorum = Septoria nodorum) war hingegen nördlich der Alpen, im Osten Amerikas und in Westaustralien heimisch.
Während der letzten Jahre hat die Bedeutung von S. tritici in Grossbritannien und in Zentraleuropa zugenommen. Lokale Weizensorten wurden durch frühreife, kurzhalmige Sorten ersetzt, die anfällig für S. tritici waren. Zudem haben auch Änderungen im Weizenanbau (frühe Saat, Direktsaat, zunehmende Stickstoffdüngung und Resistenz gegen bestimmte Fungizide) zu dieser Entwicklung beigetragen.
Die Septoria-Blattdürre beeinträchtigt die Vitalität der Weizenpflanze und kann zu Ernteverlusten von bis zu 30 Prozent führen. Durch den Anbau weniger anfälliger Sorten, eine nicht zu frühe Saat des Winterweizens, eine angepasste Fruchtfolge und das Einarbeiten von Ernterückständen kann ein Befall durch S. tritici weitgehend verhindert werden. Eine direkte Bekämpfung mit chemischen Pflanzenschutzmitteln ist ebenfalls möglich.
 Abb. 1. Blattflecken an Weizen, verursacht durch Septoria tritici
Abb. 1. Blattflecken an Weizen, verursacht durch Septoria tritici
Krankheitsbild
Typische, erste Symptome eines Befalls mit S. tritici sind ovale, gelbgrüne, chlorotische Flecken an den unteren Blättern. Sie erscheinen zu Beginn des Frühlings. Nach drei bis sechs Tagen entwickeln sich die Chlorosen zu grau-grünen Nekrosen (abgestorbenes Blattgewebe). Diese sind zuerst streifenförmig und seitlich von Blattadern begrenzt. Später können sie zu unregelmässig geformten Blattflecken zusammenwachsen. Stark befallene Blätter sterben frühzeitig ab und vertrocknen (Blattdürre). Der Pilz breitet sich normalerweise von den unteren nach den oberen Blättern aus, inklusive der Blattscheiden und des Fahnenblatts. Auch die Ähren können bei anhaltend feuchten Bedingungen befallen werden.
Innerhalb der Blattflecken sind auf beiden Blattseiten die in Reihen angeordneten, schwarzen Pyknidien (Fruchtkörper) erkennbar (Abb. 1 und 2). Bei hoher Luftfeuchtigkeit entlassen diese eine weisse, schleimige Ranke, die mit der Lupe gut sichtbar ist (Abb. 2. Bild 6). Die Ranken bestehen aus Tausenden von Pyknosporen, die in einem Gel eingebettet sind.
Verwechslungsmöglichkeiten: Auf einem Weizenblatt kommen neben der Septoria-Blattdürre meist gleichzeitig auch die Blatt- und Spelzenbräune (S. nodorum) sowie die DTR-Blattdürre (Pyrenophora tritici-repentis) vor. Eine eindeutige Unterscheidung dieser drei Blattfleckenerreger aufgrund der Symptome ist schwierig. Die Schaderreger können jedoch anhand ihrer Fruchtkörper unterschieden werden. Blattflecken, verursacht durch S. tritici, tragen auf beiden Blattseiten schwarze Fruchtkörper (Pyknidien). Die Flecken, die durch S. nodorum verursacht wurden, weisen hingegen honigbraune und etwas grössere Fruchtkörper auf. Die Pyknosporen von S. tritici sind länglich und dünn, diejenigen von S. nodorum kürzer und dicker (nur mit einem Mikroskop sichtbar). P. tritici-repentis bildet keine Fruchtkörper, sondern grosse Konidien auf langen Trägern.
Die Bestimmung des vorherrschenden Blattfleckenerregers ist wichtig für die Wahl der richtigen Sorte, da verschiedene Resistenzgene die Abwehr gegen die drei Krankheitserreger kontrollieren.
Krankheitserreger
Mycosphaerella graminicola bildet kugelige Hauptfruchtkörper, so genannte Pseudothecien, mit einem Durchmesser von 70-100 µm beträgt (Eyal et al., 1987). Diese enthalten Asci (34-41 x 11-13 µm) mit je acht Ascosporen (Bockhus et al., 2010). Letztere sind zweizellig (wobei eine Zelle grösser ist als die andere) und sind 10-15 x 2.5-3 µm gross (Bockhus et al., 2010).
Die Pyknidien der Septoria tritici sind kugelförmig, 60-200 µm gross (Eyal et al., 1987) und haben eine Öffnung (Ostiolum) (Abb. 3). In diesen Fruchtkörpern werden massenhaft längliche Pyknosporen gebildet (Abb. 4). Diese sind mindestens 10-mal länger als breit (1-3 x 35-98 µm) und haben drei bis fünf Septen. Nach Eyal et al. (1987) existieren auch Mikropyknosporen (0.8-1 x 8-10.5 µm, kein Septum), die ebenfalls den Weizen infizieren können.
S. tritici ist ein heterothallischer Pilz (Kema et al., 1996c). Bereits 1973 wurde eine physiologische Spezialisierung innerhalb der Art vermutet (Eyal et al., 1973). Kema et al. (1996a, b) zeigten später, dass Isolate von Hartweizen entweder nur diesen oder den Hart- und den Brotweizen infizieren können. Isolate von Brotweizen infizieren entweder nur den Brotweizen oder den Brot- und den Hartweizen.
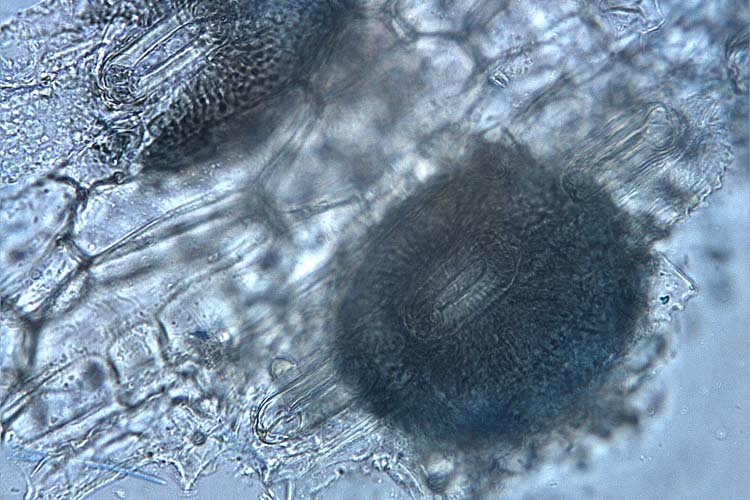
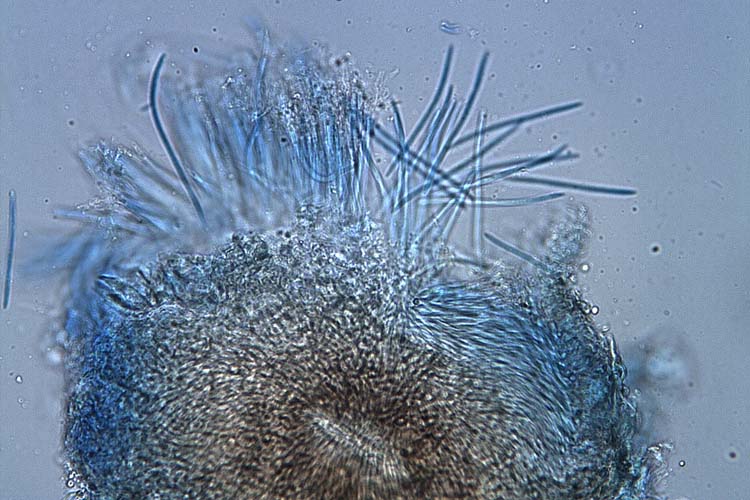 Abb. 3. In den Hohlräumen unter den Spaltöffnungen bildet Septoria tritici Pyknidien, die mit Pyknosporen gefüllt sind.
Abb. 3. In den Hohlräumen unter den Spaltöffnungen bildet Septoria tritici Pyknidien, die mit Pyknosporen gefüllt sind.
 Abb. 4. Pyknosporen der Septoria tritici
Abb. 4. Pyknosporen der Septoria tritici
Lebenszyklus
Septoria tritici überlebt die Zeit zwischen der Ernte und der Aussaat der neuen Weizenkultur (Spätsommer, Herbst und Winter) auf Strohresten an der Bodenoberfläche. Hier entsteht die sexuelle Fortpflanzungsform mit den so genannten Pseudothecien, Asci und Ascosporen. Bei hoher Luftfeuchtigkeit werden die Ascosporen aus den Asci geschleudert und gelangen mit dem Wind auf junge Weizenpflanzen. Früh gesäter Weizen kann bereits Anfang Oktober durch Ascosporen infiziert werden. Wird Weizen nach Weizen angebaut, können Pyknosporen von Ernterückständen den jungen Weizen infizieren. Auch Wildgräser werden von S. tritici infiziert und können den Pilz von einer Weizenkultur auf die nächste übertragen. Eine Übertragung von S. tritici mit dem Saatgut ist ebenfalls möglich. Dies findet allerdings, im Gegensatz zur Blatt- und Spelzenbräune, nur in Ausnahmefällen statt.
Die weitere Ausbreitung im Weizenbestand erfolgt über Pyknosporen. Diese werden als Schleimranken aus den Pyknidien (asexuelle Fruchtkörper) herausgepresst. In diesen Ranken sind die Sporen in einem Gel bestehend aus Proteinen und Kohlenhydraten eingebettet. Das Gel schützt die Sporen vor Austrocknung und verhindert ihre frühzeitige Keimung. Auf diese Weise können die Pyknosporen bei einer relativen Luftfeuchtigkeit von 35 bis 45 % bis zu 60 Tage überleben (Gough und Lee, 1985). Sobald sich das Gel mit Wasser verdünnt, wird die Keimung der Sporen angeregt. Die Keimung beginnt allerdings erst, nachdem die Spore während etwa 12 Stunden Kontakt zu einem Blatt einer Wirtspflanze hatte. Aus jeder Zelle der Spore können Keimschläuche wachsen, vorausgesetzt, es gibt ausreichend freies Wasser auf der Blattoberfläche (Weber, 1922). Zunächst wächst das Pilzmyzel an der Blattoberfläche und dringt dann durch die Spaltöffnungen in die Pflanze ein (Kema et al., 1996c). Anschliessend breiten sich die Hyphen zwischen den Mesophyllzellen aus. Nach etwa elf Tagen sterben die ersten Pflanzenzellen ab und in den Hohlräumen unter den Spaltöffnungen bilden sich Pyknidien mit Pyknosporen. Regentropfen schleudern diese auf seitliche und nächsthöhere Blätter. Bei regenreicher Witterung befällt der Pilz in kurzer Zeit auch die ertragsrelevanten oberen Blätter.
Epidemiologie
- Kühles und nasses Wetter begünstigt die Entwicklung von S. tritici. Die optimalen Temperaturen für den Verlauf der Infektion liegen zwischen 20 und 25 °C (Eyal et al., 1987). Eine Ausbreitung der Krankheit kann bereits bei milden Tagesminimumtemperaturen von 4 °C während der Wintermonate erfolgen. Hohe Temperaturen hingegen bremsen die Entwicklung der Krankheit.
- Für eine erfolgreiche Infektion sind mindestens 20 Stunden Blattnässedauer erforderlich. Je tiefer die Temperaturen sind, desto länger müssen die Nässeperioden dauern, damit sich eine Epidemie entwickeln kann.
- S. tritici hat im Vergleich zu S. nodorum eine relativ lange Inkubationszeit (Zeit zwischen Infektion und Auftreten der ersten Symptome). Bei einer Temperatur von 20-24 °C erscheinen die ersten Symptome etwa 15-21 Tage nach der Inokulation (Eyal et al., 1987). Nach Obst und Gehring (2004) beträgt die Inkubationszeit von S. tritici bei Temperaturen bis zu 10 °C 210 Gradtage (z.B.. 7 °C während 30 Tagen). Gleichzeitig mit dem Erscheinen der ersten Symptome kann auch die Neubildung von Pyknidien beobachtet werden.
- Häufiger Regen begünstigt die Verbreitung der Pyknosporen, da Regenspritzer die Sporen von den unteren auf die oberen ertragsrelevanten Blätter befördern. Kurzstrohige Sorten, Halmverkürzung sowie hohe Stickstoffgaben begünstigen diese Entwicklung.
- Mit S. tritici befallene Ernterückstände und Ausfallgetreide sowie eine frühzeitige Aussaat des Winterweizens begünstigen Epidemien.
Wirtsspektrum
S. tritici kommt in der Schweiz hauptsächlich auf Weizen (Triticum aestivum) vor, seltener auf Roggen (Secale cereale) und Triticale. In anderen Klimagebieten befällt dieser Parasit auch den Hartweizen (T. turgidum var. durum). Nach Eyal (1999) werden neben den bereits erwähnten Wirtspflanzen nach einer künstlichen Inokulation auch Arten aus folgenden Gattungen befallen: Agropyron, Agrostis, Brachypodium, Bromus, Dactylis, Festuca, Hordeum, Glyceria, Poa und Triticum.
Resistente und wenig anfällige Sorten
Für die Weizenzüchter hat die Entwicklung von resistenten oder zumindest wenig anfälligen Weizensorten eine hohe Priorität, da die Populationen von S. tritici zunehmend unempfindlich gegen die heute eingesetzten Fungizide (Strobilurine und Triazole) werden. Bis jetzt wurden 13 Resistenzgene identifiziert und kartiert, die gegen S. tritici wirksam sind: Stb1 bis Stb12 und Stb15 (Arraiano et al., 2009). Jedes dieser 13 Gene bewirkt eine Resistenz gegen ein oder mehrere bekannte Isolate von S. tritici. Europäische Weizensorten enthalten vorwiegend die Gene Stb6 und Stb15 (Arraiano und Brown, 2006). Ausserdem enthalten diese Sorten unbekannte Isolat-spezifische Resistenzgene, die noch nicht genetisch analysiert wurden. In amerikanischen Weizensorten kommen die beiden Resistenzgene Stb1, das ursprünglich aus der Sorte Bulgaria 88 stammt, und Stb4, aus der Sommerweizensorte Tadinia, häufig vor. Stb1 verlieh den in Indiana und benachbarten US Bundesstaaten während der letzten 25 Jahre angebauten Weizensorten eine dauerhafte Resistenz gegen S. tritici (Adhikari et al., 2004). Stb4 war in Kalifornien mehr als 15 Jahre wirksam, die Resistenz wurde erst kürzlich durchbrochen.
Unabhängig von diesen 13 Resistenzgenen sind grössere Weizenpflanzen weniger anfällig für S. tritici als kurzhalmige (Arraiano et al., 2009). Auch zeigen Sorten mit kurzen Blättern einen deutlich geringeren Befall als solche mit langen Blättern. Pflanzen mit mehr flach liegenden Blättern werden hingegen stärker befallen. Vermutlich weil deren Blätter eher länger sind als die von Pflanzen mit aufrecht stehenden Blättern.
Vorbeugende Massnahmen und Bekämpfung
- Eine wichtige vorbeugende Massnahme ist die sorgfältige Einarbeitung von Ernterückständen, da auf befallenen Strohresten die Hauptfruchtform des Parasiten entsteht, wodurch die Neusaaten im Herbst gefährdet werden. Auch auflaufendes Ausfallgetreide, auf dem S. tritici die Zeit zwischen den Weizenkulturen in der Nebenfruchtform überbrücken kann, muss beseitigt werden, um das Risiko eines Befalls im Herbst zu verringern.
- Winterweizen sollte nicht zu früh gesät werden. Es wird ausserdem empfohlen, wenig anfällige Sorten zu wählen (Schweiz: Liste der empfohlenen Getreidesorten; Deutschland: Sortenliste des Bundessortenamtes; Österreich: Österreichische beschreibende Sortenliste).
- Weniger Weizen in der Fruchtfolge, der Verzicht auf Wachstumsregler und Zurückhaltung in der N-Düngung
- Eine direkte Bekämpfung mit chemischen Pflanzenschutzmitteln ist möglich. In der Schweiz sind Betriebe, die gemäss dem ökologischen Leistungsnachweis (ÖLN) wirtschaften, verpflichtet, Pflanzenschutzmittel nur gemäss dem Schadschwellenprinzip anzuwenden. Schadschwellen, bzw. Bekämpfungsschwellen, geben einen Anhaltspunkt, ab welcher Dichte eine Bekämpfung mit Pflanzenschutzmitteln erfolgen soll und wirtschaftlich sinnvoll ist.
Die Bekämpfungsschwelle für Blattflecken an Weizen, Triticale und Roggen ist in der Schweiz wie folgt festgesetzt (Agridea, Datenblätter Ackerbau): Während der Entwicklungsstadien 37 (Fahnenblattspitze sichtbar) bis 51 (Beginn des Ährenschiebens) wird jeweils das viert-oberste Blatt von 100 Halmen ausgezählt. Dabei werden Blattflecken, die durch Septoria Arten (S. tritici und S. nodorum) und DTR Blattdürre (Drechslera tritici-repentis) verursacht wurden, zusammengezählt. Die Bekämpfungsschwelle ist erreicht, wenn 20 % der Blätter befallen sind. - Empfohlene und zugelassene Pflanzenschutzmittel zum Schutz gegen die Septoria Blattdürre finden Sie für die Schweiz im BLW Pflanzenschutzmittelverzeichnis (Bundesamt für Landwirtschaft); für Deutschland in der online Datenbank des BVL (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) und für Österreich im Pflanzenschutzmittelregister des BAES (Bundesamt für Ernährungssicherheit).
Literatur
Adhikari TB, Yang X, Cavaletto JR, et al., 2004. Molecular mapping of Stb1, a potentially durable gene for resistance to septoria tritici blotch in wheat. Theoretical and Applied Genetics 109: 944-953.
Agridea, 2021. Datenblätter Ackerbau. AGRIDEA, CH-8315 Lindau (Bekämpfungsschwellen)
Arraiano LS, Brown JKM, 2006. Identification of isolate-specific and partial resistance to septoria tritici blotch in 238 European wheat cultivars and breeding lines. Plant Pathology 55: 726-738.
Arraiano LS, Balaam N, Fenwick PM, Chapman C, Feuerhelm D, Howell P, Smith SJ, Widdowson JP, Brown JKM, 2009. Contributions of disease resistance and escape to the control of septoria tritici blotch of wheat. Plant Pathology 58: 910-922.
Bockus WW, Bowden RL, Hunger RM, Morrill WL, Murray TD, Smiley RW, 2010. Compendium of wheat Diseases and Pests. Third edition. The American Phytopathological Society, St. Paul Minnesota: 171 p.
Eyal Z, Amiri Z, Wahl I., 1973. Physiologic specialisation of Septoria tritici. Phytopathology 63: 1087-1091.
Eyal Z, Scharen AL, Prescott JM, van Ginkel M, 1987. The Septoria diseases of wheat: Concepts and methods of disease management. Mexico, D.F.: CIMMYT.
Eyal Z, 1999. The septoria tritici and stagonospora nodorum blotch diseases of wheat. European Journal of Plant Pathology 105: 629-641.
Gough FJ, Lee TS, 1985. Moisture effects on the discharge and survival of conidia of Septoria tritici. Phytopathology 75: 180-182.
Häni FJ, Popow G, Reinhard H, Schwarz A, Voegeli U, 2008. Pflanzenschutz im nachhaltigen Ackerbau. Edition LMZ, 7. Auflage. 466 S.
Kema GHJ, Annone JG, Sayoud R, Van Silfhout CH, Van Ginkel M, de Bree J, 1996a. Genetic variation for virulence and resistance in the wheat – Mycosphaerella graminicola pathosystem I. Interaction between pathogen isolates and host cultivars. Phytopathology 86: 200-212.
Kema GHJ, Sayoud R, Annone JG, Van Silfhout CH, 1996b. Genetic variation for virulence and resistance in the wheat – Mycosphaerella graminicola pathosystem II. Analysis of interactions between pathogen isolates and host cultivars. Phytopathology 86: 213-220.
Kema GHJ, DaZhao Y, Rijkenberg FHJ, Shaw MW, Baayen RP, 1996c. Histology of the pathogenesis of Mycosphaerella graminicola in wheat. Phytopathology 86: 777-786.
Kema GHJ, Verstappen ECP, Todorova M, Waalwijk C, 1996d. Successful crosses and molecular tetrad and progeny analyses demonstrate heterothallism in Mycosphaerella graminicola. Current Genetics 30: 251-258.
Obst A, Gehring K, 2004. Getreide - Krankheiten Schädlinge, Unkräuter. Verlag Th. Mann: 256 S.
Weber GF, 1922. Septoria diseases of cereals. Phytopathology 12: 537-585.



