Schwarzrost des Getreides
rouille noire (fr.); stem rust oder black rust (engl.)
Wissenschaftlicher Name: Puccinia graminis ssp. graminis
Taxonomie: Fungi, Basidiomycota, Pucciniomycetes, Pucciniales, Pucciniaceae
früher: Heterobasidiomycetes, Uredinales, Pucciniaceae
Der Schwarzrost des Getreides (Puccinia graminis ssp. graminis) befällt Weizen, Triticale, Roggen, Hafer und gelegentlich auch die Gerste, wobei jeweils unterschiedliche Formen auftreten: So kann der Weizenschwarzrost beispielsweise den Roggen nicht infizieren und umgekehrt. Zwischenwirt dieses wirtswechselnden Rostpilzes ist die Berberitze (Berberis vulgaris) auf der er Spermogonien und Aecidien bildet.
Die Rostpusteln des Getreideschwarzrosts befinden sich vorwiegend auf Blattscheiden und Halmen (englisch: stem rust). Die Sporenlager sind von der aufgerissenen Epidermis umgeben.
Obwohl der Schwarzrost weltweit zu den gefährlichsten Getreideparasiten zählt, ist er in der Schweiz und Deutschland nur selten ertragsschädigend. Durch die Wahl resistenter, frühreifer Sorten kann einem Befall vorgebeugt werden. Auch die Beseitigung des Zwischenwirts (Berberitze) sollte weiterhin Beachtung finden.
 Abb. 1. Teleutolager der Puccinia graminis f.sp. secalis (Schwarzrost) an Halmen des Roggens (Secale cereale)
Abb. 1. Teleutolager der Puccinia graminis f.sp. secalis (Schwarzrost) an Halmen des Roggens (Secale cereale)
Bemerkungen zur Taxonomie der P. graminis
Puccinia graminis ist eine Kollektivart (Sammelart) und umfasst alle Rostpilze an Gräsern mit nackten Teleutolagern, die auf Berberis sp. (Berberitze) als Zwischenwirt hinüberwechseln (Gäumann 1959). Der gesamte Formenkreis umfasst Hunderte von Teleutosporen- und Dutzende von Aecidienwirten mit allen möglichen morphologischen und biologischen Besonderheiten. Innerhalb der Art P. graminis werden (je nach Autor) zahlreiche Subspezies (ssp.), Varietäten (var.) und formae speciales (f. sp.) unterschieden.
Urban (1967) teilt die Art P. graminis in die beiden Subspecies (ssp.) graminis und graminicola. Die erste Subspecies unterteilt er nochmals in die Varietäten (var.) graminis und stakmanii.
P. graminis ssp. graminis var. graminis befällt Arten der Gattungen Triticum (Weizen), Aegilops und Elymus.
P. graminis ssp. graminis var. stakmanii wächst unter anderem auf Arten der Gattungen Avena (Hafer), Hordeum (Gerste) und Secale (Roggen).
Die P. graminis ssp. graminicola parasitiert auf Arten der Gattungen Agrostis, Alopecurus, Arrhenatherum, Dactylis, Festuca, Lolium, Phleum und Poa sowie zahlreichen anderen Gräsern.
Andere Autoren unterscheiden beim Schwarzrost des Getreides (P. graminis ssp. graminis) drei formae speciales:
- f. sp. tritici (Erikss. et Henn.) kommt auf Weizen, gelegentlich auch auf einigen Arten der Gattungen Hordeum (zum Beispiel Gerste), Aegilops, Avena und Agropyron vor.
- f. sp. secalis befällt den Roggen, die Gerste und einige andere Gräser
- f. sp. avenae befällt Hafer, Flughafer und weitere Grasarten
Schadbild und Schadwirkung an Getreide
Während des Sommers erscheinen vorwiegend an den Blattscheiden, Halmen und Ähren (Spelzen und Spindeln) längliche, rötlich braune bis kaffeebraune Uredolager, auch Rostpusteln genannt. Sie sind 2-3 mm lang und damit deutlich grösser als diejenigen der anderen Getreideroste. Die Uredolager wachsen häufig zusammen, so dass sie vor allem auf den Halmen ausgedehnte, streifenförmige Pusteln bilden und oft grosse Flächen bedecken. Nach dem Aufreissen der Epidermis über den sich bildenden Uredolagern wird eine pulverförmige Masse frei. Die aufgerissene Epidermis ist am Rande der Pusteln deutlich sichtbar.
Die Teleutolager (Abb. 1 und 2) befinden sich vorwiegend auf den Blattscheiden und den Halmen. Sie sind schwarz-braun, länglich (bis zu 10 mm lang) und nur kurze Zeit von der Epidermis bedeckt. Die Reste der Epidermis sind meist beidseits der Lager sichtbar. Sie sind zerstreut angeordnet, einzelne Lager können ineinanderfliessen und lange Streifen bilden.
Schadwirkung: Ein Befall der Halme mit Uredolagern erhöht den Wasserverbrauch der Pflanze. Zusätzlich wird die Epidermis durch den Rostpilz beschädigt, was die Verdunstung von Wasser nochmals erhöht.
Zudem werden viele Nährstoffe, die der Pflanze normalerweise zur Verfügung stehen, vom Pathogen für die Produktion von Uredosporen verbraucht. Die Photosynthese befallener Pflanzen ist reduziert, da ein grosser Teil der grünen Pflanzenteile durch den Pilz zerstört ist. All dies hat zur Folge, dass für die Produktion einer normalen Anzahl Samen nicht genügend Wasser und Nährstoffe zur Verfügung stehen. Ausserdem reifen befallene Halme früher ab, so dass der Pflanze weniger Zeit bleibt, die Samen auszubilden.

 Abb. 2. Uredo- und Teleutolager des Schwarzrosts (Puccinia graminis f. sp. secalis) an Roggen
Abb. 2. Uredo- und Teleutolager des Schwarzrosts (Puccinia graminis f. sp. secalis) an Roggen
Krankheitserreger
Die Uredosporen (Abb. 3) sind länglich oval und 20-30 x 14-20 µm gross (Cummins 1971). Ihre Wand ist 1.5-2.5 µm dick, gelb bis goldbraun und besitzt entfernt stehende Stachelwarzen. Auffallend sind die vier (selten drei oder fünf) Keimporen, die kreuzweise am Sporen-Äquator angeordnet sind. Diese Anordnung der Keimporen ist für die Art typisch und als Erkennungsmerkmal gut geeignet.
Die Teleutosporen (Abb. 4) messen 34-60 x 16-23 µm (Cummins 1971). Ihre Form ist sehr unterschiedlich. Sie sind zweizellig, im Allgemeinen spindel- bis keulenförmig, in der Mitte leicht eingeschnürt und am Scheitel gerundet oder zugespitzt. Die Wand ist 1.5-2 µm dick (am Scheitel stark verdickt 5-11 µm), glatt, gelb- bis dunkel-braun. Typischerweise haben die Teleutosporen einen etwa 50 µm langen Stiel. Am Scheitel sind sie abgerundet bis leicht zugespitzt.
Die Spermogonien werden an der Blattoberseite der Berberitze auf orange bis rot gefärbten Flecken gebildet (Abb. 8). Sie entstehen unter der Epidermis, sind kugelig und haben einen Durchmesser von 120-130 µm. Die Empfängnishyphen ragen bis zu 60 µm hervor (Abb. 5).
Die becherförmigen, in Gruppen angeordneten Aecidien brechen an der Blattunterseite oder an Blattstielen hervor (Abb. 9). Im Innern werden Aecidiosporen (16-23 x 15-19 µm; Cummins 1971) gebildet (Abb. 6). Sie sind rundlich bis leicht oval. Die Wand ist dünn (1 µm), farblos und sehr fein warzig. Der Sporeninhalt ist gelb.
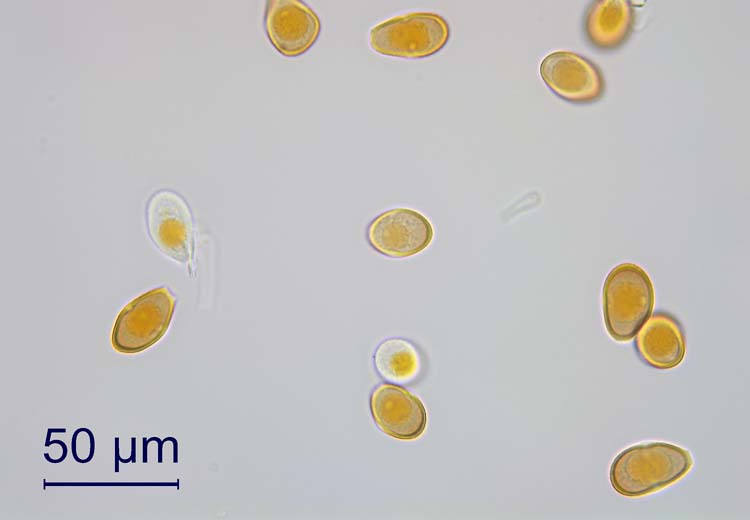
 Abb. 3. Uredosporen der Puccinia graminis, Verursacher des Schwarzrosts an Getreide
Abb. 3. Uredosporen der Puccinia graminis, Verursacher des Schwarzrosts an Getreide
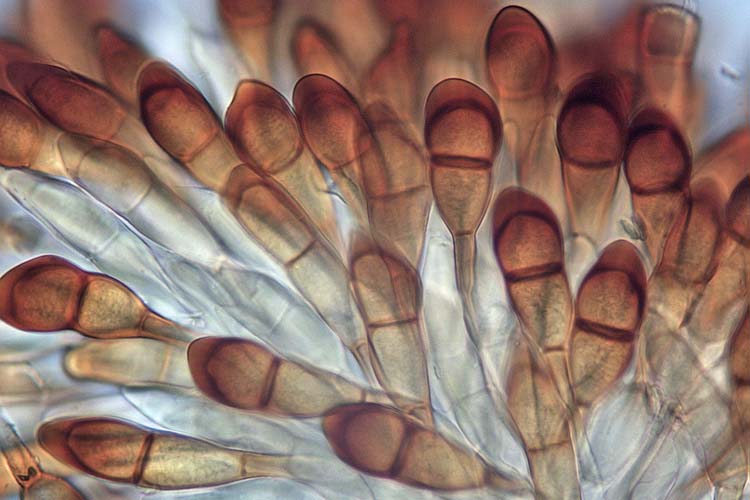
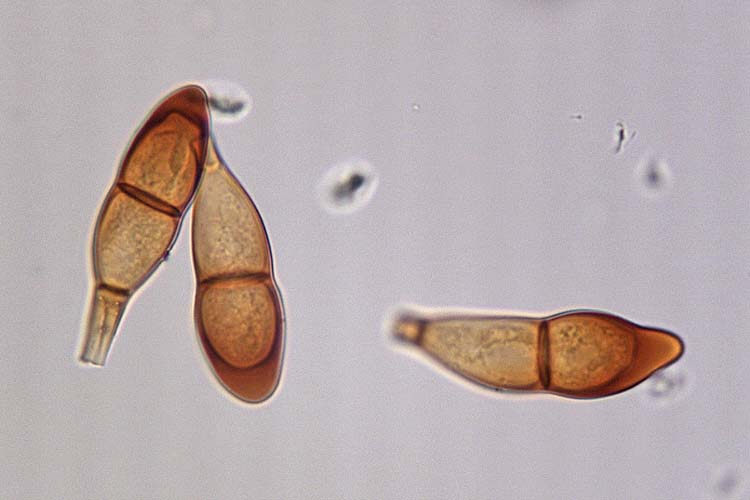 Abb. 4. Teleutosporen der Puccinia graminis f. sp. secalis, Verursacher des Schwarzrosts an Roggen
Abb. 4. Teleutosporen der Puccinia graminis f. sp. secalis, Verursacher des Schwarzrosts an Roggen
 Abb. 5. Spermogonium mit Empfängnishyphen der Puccinia graminis f. sp. secalis an Berberitze (Berberis vulgaris)
Abb. 5. Spermogonium mit Empfängnishyphen der Puccinia graminis f. sp. secalis an Berberitze (Berberis vulgaris)
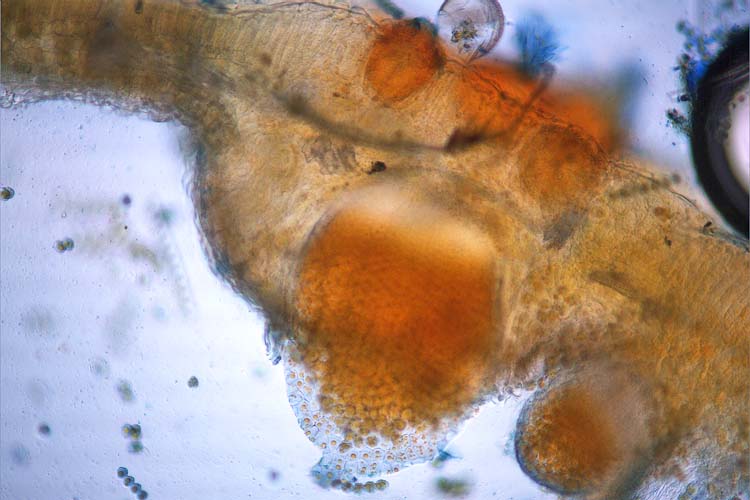 Abb. 6. Aecidium mit Aecidiosporen der Puccinia graminis f. sp. secalis an Berberitze (Berberis vulgaris)
Abb. 6. Aecidium mit Aecidiosporen der Puccinia graminis f. sp. secalis an Berberitze (Berberis vulgaris)
Lebenszyklus
Schwarzrost ist ein wirtswechselnder Rostpilz mit vollständigem Lebenszyklus. Ab Juni, bildet der obligate Parasit Uredolager, die vorwiegend an den Blattscheiden und Halmen, gelegentlich auch an den Blättern zu finden sind. In diesen Lagern wachsen zahlreiche Uredosporen, welche von der Luftströmung erfasst und auf andere Pflanzen übertragen werden. Starke Winde können die Sporen auch hunderte von Kilometer weit tragen und dem Rostpilz so die Besiedlung neuer Gebiete ermöglichen. Dies ist vor allem bei der grossräumigen Verbreitung der verschiedenen Rassen wichtig.
Bei Vorhandensein eines Wasserfilms auf der Blattoberfläche (zum Beispiel Tau im Sommer) keimen die Uredosporen und infizieren das Getreide durch die Spaltöffnungen (Stomata). Innerhalb von 8 – 14 Tagen nach der Inokulation werden neue Uredolager mit mehreren hunderttausend Sporen gebildet. Während einer Vegetationsperiode können bei günstigen Wetterverhältnissen mehrere Generationen von Sporen gebildet werden. Dabei entsteht eine gewaltige Menge an Uredosporen.
Gegen Ende des Sommers entstehen entweder in bestehenden Uredolagern oder in neu gebildeten Lagern die Teleutosporen. Diese Sporen überwintern auf dem Pflanzenmaterial und keimen erst nach einer Ruhephase, meist im folgenden Frühjahr.
Während der Keimung erfolgt in den Teleutosporen die Karyogamie (Verschmelzung der beiden Zellkerne). Nach einer anschliessenden Meiose wird pro Zelle einer Teleutospore eine vierzellige Basidie mit vier haploiden Basidiosporen gebildet (Abb. 7). Die Basidiosporen werden durch den Wind auf den Zwischenwirt, die Berberitze (Berberis vulgaris), übertragen, können dabei allerdings keine grösseren Distanzen zurücklegen.
Dort keimen die Basidiosporen aus und dringen direkt in die Epidermiszellen ein. Das haploide Myzel wächst interzellulär und bildet Haustorien in die Zellen, um sich zu ernähren.
Nach einigen Tagen entstehen an der Blattoberseite die Spermogonien (Abb. 6), in denen, eingebettet in einer klebrigen Flüssigkeit, Spermatien gebildet werden. Aus den Spermogonien ragen Empfängnishyphen. Insekten, die durch den spezifischen Duft der Spermogonien angelockt werden, übertragen die Spermatien auf sexuell kompatible Empfängnishyphen. Spermatien können auch durch Regen oder Tautropfen übertragen werden. Sobald ein Spermatium auf eine Empfängnishyphe eines kompatiblen Spermogoniums trifft, kommt es zur Befruchtung. Dabei verschmelzen die beiden Kerne allerdings nicht und der dikaryotische Zustand des Pilzes ist somit wieder hergestellt. Das dikaryotische Myzel bildet normalerweise an der Blattunterseite einen Knäuel, der sich zu einem Aecidium (Abb. 6) entwickelt. In den Aecidien werden Aecidiosporen in Ketten gebildet. Jede Spore enthält zwei separate Kerne, je einen eines entgegengesetzten Paarungstyps.
Die Aecidiosporen gelangen mit dem Wind auf nahegelegenes Getreide, keimen dort unter günstigen Bedingungen aus und dringen durch die Spaltöffnungen ins Pflanzengewebe ein. Das Myzel wächst interzellulär, ernährt sich über Haustorien in den Wirtspflanzenzellen und bildet erneut Uredolager.
In kühleren Klimazonen muss der Schwarzrost den vollständigen Zyklus durchlaufen, um am Standort zu überleben. Allerdings können im Frühjahr auch Uredosporen über weite Strecken aus weit entfernten Gebieten (auf sogenannten Roststrassen) hereingeweht werden und das Getreide infizieren. In wärmeren Gebieten kann der Schwarzrost auch als Myzel auf lebendem Pflanzenmaterial oder als Uredospore überwintern.
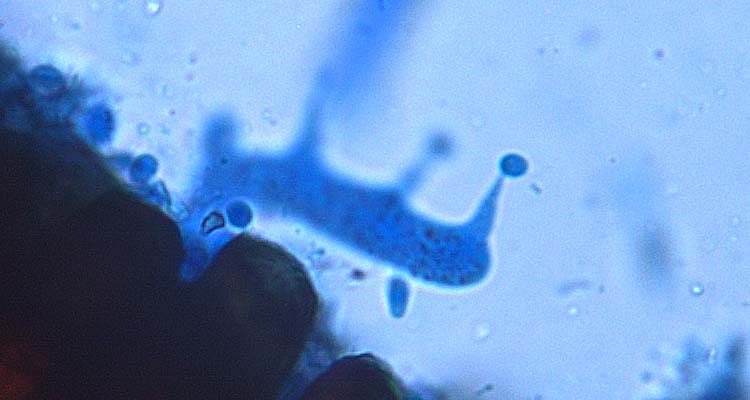 Abb. 7. gekeimte Teleutospore der Puccinia graminis f. sp. secalis: Basidie mit Basidiosporen
Abb. 7. gekeimte Teleutospore der Puccinia graminis f. sp. secalis: Basidie mit Basidiosporen
 Abb. 8. Spermogonien des Schwarzrosts (Puccinia graminis f. sp. secalis) an der Berberitze (Berberis vulgaris)
Abb. 8. Spermogonien des Schwarzrosts (Puccinia graminis f. sp. secalis) an der Berberitze (Berberis vulgaris)
 Abb. 9. Aecidien des Schwarzrosts (Puccinia graminis f.sp. secalis) an der Berberitze (Berberis vulgaris)
Abb. 9. Aecidien des Schwarzrosts (Puccinia graminis f.sp. secalis) an der Berberitze (Berberis vulgaris)
Epidemiologie
Im Allgemeinen benötigt P. graminis für eine optimale Entwicklung eine etwas höhere Temperatur als P. striiformis. Laut Zadok (1965) liegen die optimalen Temperaturen für die Keimung der Uredosporen von P. graminis (auf Weizen) bei 15-24 °C und für die Bildung der Appressorien bei 16-26 °C. Eine lange Periode mit wolkenlosen, sonnigen Tagen und kühlen Nächten sowie einer lange anhaltenden Taubildung am Morgen (mehr als 8 Stunden) ist optimal für die Entstehung einer Schwarzrostepidemie (Obst und Paul 1993). Sind die Temperaturen zudem günstig für die Keimung und die Bildung von Appressorien, können die Uredosporen innerhalb von 8 bis 10 Stunden über die Spaltöffnungen in das Getreide eindringen. Acht bis zehn Tage später entwickeln sich Uredolager, welche Uredosporen in grosser Zahl bilden. Jede dieser Sporen kann wiederum Getreide infizieren und ein weiteres Uredolager hervorbringen.
Obwohl der Schwarzrost zu den weltweit gefährlichsten Getreideparasiten zählt, tritt er in der Schweiz an Weizen nur noch in einzelnen Voralpentälern auf, wo Weizen als Sommerfrucht angebaut wird (Häni et al. 2008). Auch in Deutschland ist er selten ertragsschädigend (Obst und Paul 1993). An Roggen ist er hingegen häufig zu sehen. Es wird vermutet, dass der Roggenschwarzrost in der Form von Myzel oder Uredosporen auf Wildgräsern überwintern kann. Er tritt aber an Roggen zu spät auf, um noch einen Schaden anzurichten.
Wirtsspektrum
- Weizenschwarzrost (Puccinia graminis ssp. graminis f. sp. tritici) kommt an Weizen (Triticum aestivum) und Triticale vor. Im Mittelmeerraum befällt er ausserdem einige Arten der Gattungen Hordeum, Aegilops, Avena und Agropyron (Obst und Paul 1993).
- Roggenschwarzrost (Puccinia graminis ssp. graminis f. sp. secalis) befällt den Roggen (Secale cereale) und gelegentlich auch die Gerste (Hordeum vulgare). Er kann aber Weizen nicht infizieren.
- Haferschwarzrost (Puccinia graminis ssp. graminis f. sp. avenae) parasitiert auf dem Hafer (Avena sativa), Flughafer und einigen Gräserarten.
- Gerste ist ein Spezialfall, weil sie von zwei verschiedenen formae speciales befallen wird, von der f. sp. tritici und der f. sp. secalis.
Zwischenwirt dieses wirtswechselnden Rostpilzes (gilt für alle drei formae speciales) ist die Berberitze (Berberis vulgaris), teilweise auch Mahonie-Arten, auf denen er Spermogonien und Aecidien bildet.
Jede forma specialis des Schwarzrosts umfasst zahlreiche physiologische Rassen, die nur bestimmte Sorten oder Genotypen einer Wirtsart befallen. Eine Rasse hat die Fähigkeit bestimmte Resistenzgene zu überwinden. Dies führt bei einer Pflanze, die nur dieses Resistenzgen enthält, zu einer Infektion und zur Bildung von Uredosporen (=Rasse ist virulent). Pflanzen, die Resistenzgene enthalten, welche von dieser bestimmten Rasse nicht überwunden werden können, bleiben gesund (= Rostrasse ist avirulent). Hier setzt die Pflanzenzüchtung an. Sie versucht möglichst breit wirksame Resistenzgene in einer Pflanze oder Sorte zu vereinen, um diese gegen möglichst viele Rostrassen resistent zu machen. Die Resistenzzüchtung erleidet aber immer wieder Rückschläge, da durch die sexuelle Rekombination auf dem Zwischenwirt neue Rostrassen entstehen können oder neue Rassen in ein vorher nicht besiedeltes Gebiet einwandern.
Rasse UG99
Ug99 ist eine neue Rasse des Weizenschwarzrosts. Sie erhielt ihren Namen, weil sie erstmals 1999 in Uganda entdeckt wurde. Seither hat sich Ug99 rasend schnell ostwärts verbreitet: Ausgehend von Ostafrika (Uganda, Kenia, Äthiopien usw.) breitete sie sich in wenigen Jahren auch in den Jemen und den Iran aus (Vaidyanathan 2011). Agronomen befürchten jetzt, dass der Rost weiter nach Indien und China wandert und dort enorme Ernteverluste anrichtet. Auch die grossen Weizenanbaugebiete in Nordamerika sind bedroht. Hat sich Ug99 einmal in Mexiko etabliert, können die Uredosporen vom Wind schnell bis hinauf nach Kanada getragen werden. Für die Schweizer Landwirtschaft stellt Ug-99 vorerst keine grosse Gefahr dar. Die Uredosporen und das Myzel der neuen Rasse des Schwarzrosts würden unsere kalten Winter nicht überleben. Ug99 müsste zuerst den Zwischenwirt infizieren oder es müssten jedes Jahr neue Sporen aus wärmeren Regionen im Süden auf die Felder im Norden gelangen.
Neunzig Prozent aller weltweit angebauten Weizensorten sind anfällig für Ug99. Sie alle tragen das Resistenzgen Sr31, das Ug99 überwunden hat. Sr31 liegt auf der 1BL.1RS Weizen-Roggen Translokation. Dieses Stück des Roggenchromosoms wurde aufgrund wichtiger Resistenzgene und eines besseren Ertrags weltweit in zahlreiche Weizensorten eingekreuzt.
Seit der Entdeckung von Ug99 wurden sieben Varianten der Ug99 gefunden von denen jede eine andere Kombination von Resistenzgenen überwinden kann. Eine mögliche Erklärung für diese hohe Mutationsrate könnte die enorme Anzahl an Sporen sein, die jedes Jahr in den betreffenden Ländern gebildet wird: Je grösser die Anzahl an Sporen, desto häufiger finden sich Mutationen.
Dies macht die Arbeit der Pflanzenzüchter nicht einfach. Sie versuchen die bereits bekannten rund fünfzig Resistenzgene und neue Resistenzquellen gegen Schwarzrost so zu kombinieren, dass die neu gezüchteten Linien resistent sind. Ein anderer Ansatz ist die Verwendung von sogenannten „minor genes" mit einer quantitativen Wirkung. Das heisst jedes dieser Gene erhöht die Resistenz gegen Schwarzrost, unabhängig von der Rostrasse, nur geringfügig. Durch die Kombination von mehreren solcher „minor genes" wird die Wirkung aber gegenseitig verstärkt. Eine solche Resistenz ist zudem dauerhaft.
Im Jahre 2005 entstand mit der Borlaug Global Rust Initiative (BGRI) ein internationales Konsortium zur Bekämpfung von Ug99. Ziel ist es, gegen Schwarzrost resistente Weizensorten für afrikanische und asiatische Länder zu züchten.
Vorbeugende Massnahmen und Bekämpfung
Schwarzrost ist sowohl in Nordamerika als auch weltweit eine gefürchtete Krankheit des Weizens. Eine grossflächige Rodung der Berberitze war in Nordamerika sehr erfolgreich. Dadurch wurde der Entwicklungszyklus des Schwarzrosts vor Ort unterbrochen. Eine Epidemie, verursacht durch aus dem Süden eingeflogene Uredosporen, beginnt viel später und hat nicht mehr diese verheerende Wirkung wie früher.
In der Schweiz sind keine speziellen Massnahmen erforderlich, da der Schwarzrost des Getreides bei uns selten in nennenswertem Ausmass vorkommt. Im Übrigen können folgende vorbeugende Massnahmen getroffen werden:
- Mit einer angepassten Düngung wird die Pflanzenentwicklung gefördert
- Frühreife und wenig anfällige oder resistente Sorten anbauen (die Anfälligkeit der Weizensorten für Schwarzrost ist in der für Österreich geltenden Sortenliste beschrieben)
- Den Zwischenwirt Berberitze nicht in Hecken anpflanzen oder gegebenenfalls vernichten
Literatur
Cummins GB, 1971. The rust Fungi of Cereals, Grasses and Bamboos. Springer Verlag Berlin: 570 S.
Gäumann E, 1959. Beiträge zur Kryptogamenflora der Schweiz (Band XII): Die Rostpilze Mitteleuropas, Büchler und Co. 1407 S.
Häni FJ, Popow G, Reinhard H, Schwarz A, Voegeli U, 2008. Pflanzenschutz im nachhaltigen Ackerbau. Edition LMZ, 7. Auflage. 466 S.
Obst A, Paul V, 1993. Krankheiten und Schädlinge des Getreides. Verlag Th. Mann: 184 S.
Urban Z, 1967. The taxonomy of some European graminicolous rusts. Ceska Mykol. 21, 12-16.
Vaidyanathan G, 2011. The wheat stalker. Nature, Vol. 474:563-565.
Zadoks JC, 1965. Epidemiology of wheat rusts in Europe. FAO Plant Prot. Bull., 13 (5): 97-108.



