Ährenfusariose
fusariose de l'épi du blé, brûlure des épis (franz.); Fusarium head blight, scab (engl.)
Verursacher der Ährenfusariose oder partiellen Taubährigkeit sind pilzliche Erreger der Gattung Fusarium:
- Fusarium graminearum Schwabe; Hauptfruchtform (Teleomorph): Gibberella zeae (Schweinitz) Petch
- F. culmorum (W. G. Smith) Sacc.; Hauptfruchtform unbekannt
- F. avenaceum (Fr.) Sacc.; Hauptfruchtform: Gibberella avenaceae R. J. Cook
- F. poae (Peck) Wollenw.; Hauptfruchtform unbekannt
- F. equiseti (Corda.) Sacc.; Hauptfruchtform: Gibberella intricans Wollenw.
- und andere
Taxonomie (Beispiel F. graminearum): Fungi, Ascomycota, Sordariomycetidae, Hypocreales, Nectriaceae
Fusarium-Pilze kommen in allen Böden vor. Sie spielen eine wichtige Rolle beim Abbau abgestorbener Pflanzenreste. Einige Arten sind als Pflanzenkrankheiten bekannt. Sie verursachen unter anderem Keimlings- und Auflaufkrankheiten, Krankheiten an der Halmbasis und den Wurzeln sowie Ährenfusariosen an Getreide.
Die wichtigsten Erreger der Ährenfusariosen oder partiellen Taubährigkeit sind Fusarium graminearum und F. culmorum. Am stärksten betroffen ist in der Regel der Hartweizen, gefolgt von Brotweizen, Triticale, Roggen, Hafer und Gerste. Die Pilze befallen die Ähren und mindern sowohl den Ertrag als auch die Qualität, da sie Pilzgifte (Mykotoxine) bilden, welche die Gesundheit von Menschen und Tieren beeinträchtigen. Der Anbau von Weizen nach Mais, bei gleichzeitiger minimaler Bodenbearbeitung, ist der grösste Risikofaktor für das Auftreten der Ährenfusariose. Eine Reduktion des Befalls kann bereits durch eine sorgfältige Zerkleinerung und Einarbeitung der befallenen Stoppelreste von Mais und Getreide erreicht werden.
 Abb. 1. Ährenfusariose an Weizen (Fusarium graminearum)
Abb. 1. Ährenfusariose an Weizen (Fusarium graminearum)
Schadbild der Ährenfusariose
Fusarium-Pilze können Keimlings- und Auflaufkrankheiten, Fusskrankheiten an der Halmbasis und den Wurzeln sowie die Ährenfusariose verursachen. Letztere wird in der Schweiz weitaus am häufigsten durch die Pilzarten Fusarium graminearum und F. culmorum verursacht.
Nach der Blüte verlieren einzelne Ährchen, Teile von Ähren oder ganze Ähren vorzeitig ihre grüne Farbe und bleichen aus (Abb. 1 und 2). Bei feuchtwarmer Witterung bilden die Fusarien an den Spelzen Sporenlager (Sporodochien) mit rosafarbenen Sporen. Die Kornanlagen und ganze Ährchen sterben ab oder es wachsen nur noch Schrumpfkörner. Spät mit Fusarienpilzen infizierte Körner können zwar gesund aussehen, sind aber dennoch mit Mykotoxinen kontaminiert.
Zur Erntezeit sind die mit Fusarien befallenen Ähren häufig mit Schwärzepilzen besiedelt.
Werden befallene Körner wieder ausgesät, können Keimlings- oder Fusskrankheiten entstehen.
Die verschiedenen Fusarium-Arten, die auf Getreideähren wachsen, lassen sich anhand ihrer Symptome nicht unterscheiden. Nur eine mikroskopische Untersuchung der Sporen kann hier weiterhelfen.
Mögliche Verwechslungen: Schneeschimmel (Microdochium nivale) ruft ähnliche Symptome hervor. Eine Unterscheidung der Symptome ist wichtig, da der Schneeschimmel keine Mykotoxine bildet.
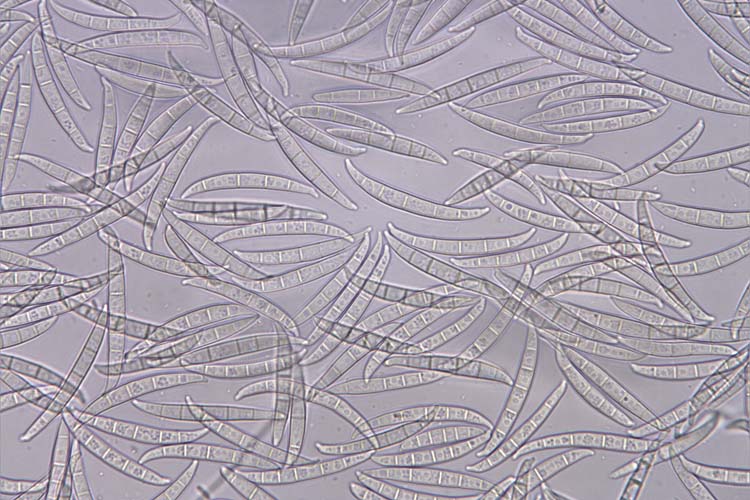 Abb. 3. Makrokonidien von Fusarium graminearum
Abb. 3. Makrokonidien von Fusarium graminearum
Beschreibung der Krankheitserreger
Die verschiedenen, an Getreide vorkommenden Fusarium-Arten bilden charakteristische Konidien und Fruchtkörper aus. Die Arten lassen sich nur mithilfe eines Mikroskops unterscheiden:
- Fusarium graminearum: Die Makrokonidien (Abb. 3) sind hyalin, gerade oder sichelförmig gekrümmt, drei- bis siebenfach septiert und messen 35-62 x 2.5-5.0 µm (Wiese 1977). Die Krümmung ist bei den zugespitzten Endzellen ausgeprägt. Die Fusszellen sind verlängert, leicht gebogen und spitz zulaufend („Füsschen"). Kugelförmige Chlamydosporen (Durchmesser 10-12 µm) werden oft erst sehr spät gebildet und nur von wenigen Isolaten (siehe unten: Ergänzung zu F. graminearum). F. graminearum bildet keine Mikrokonidien. Die Hauptfruchtform (Gibberella zeae) bildet Perithecien mit Asci und Ascosporen (Abb. 4 und 5). Die schwarzen, eiförmigen Perithecien wachsen meist in Gruppen an der Oberfläche und messen 150-350 µm im Durchmesser (Bockus et al. 2010). Die keulenförmigen Asci sind 60-85 x 8-11 µm gross und enthalten 8 Ascosporen. Diese sind hellbraun, dreifach septiert, leicht gebogen, an den Enden abgerundet und messen 20-25 x 3-4 µm.
- F. culmorum: Die Makrokonidien sind leicht gebogen, drei- bis fünffach septiert und messen 25-50 x 4-7 µm (sind dicker als die von F. graminearum) (Wiese 1977). Die Endzellen sind zugespitzt und die Fusszellen bilden deutliche, charakteristische „Füsschen". Häufig sind dickwandige, kugelförmige Chlamydosporen mit einem Durchmesser von 9-14 µm zu sehen. F. culmorum bildet keine Mikrokonidien und keine Hauptfruchtform.
- Fusarium avenaceum: Die Makrokonidien sind spindelförmig, gebogen, vier- bis siebenfach septiert und 40-80 x 3.5-4 µm gross (Wiese 1977). Die Endzellen sind verlängert und die Fusszellen haben auffällige „Füsschen". Chlamydosporen sind normalerweise nicht vorhanden. Mikrokonidien sind ein- bis dreifach septiert und messen 8-50 x 3-4.4 µm. Die Hauptfruchtform (Gibberella avenaceae) bildet Perithecien mit Asci und Ascosporen. Die dunklen, kugelförmigen Perithecien wachsen in Gruppen und erreichen einen Durchmesser von 125-265 µm. Die keulenförmigen Asci sind 50-80 µm lang und 4-10 µm breit und enthalten 6-8 Ascosporen. Diese sind hyalin, ellipsoidisch, meistens einfach - gelegentlich aber auch bis dreifach septiert und messen 13-17 x 3.3-6.5 µm.
- F. poae: Makrokonidien werden nur selten gebildet. Sie sind relativ kurz, dreifach septiert und besitzen „Füsschen" bildende Fusszellen. Mikrokonidien sind dagegen kugelförmig und normalerweise nicht septiert.
- F. equiseti: Die langen bis sehr langen Makrokonidien sind 22-60 µm und 3.5-6 µm breit. Sie haben 4 bis 7 deutlich sichtbare Septen. Die Endzellen sind deutlich gebogen und die Fusszellen bilden charakteristische „Füsschen". Mikrokonidien werden keine gebildet. Die Hauptfruchtform heisst Gibberella intricans, sie kann aber nur sehr selten beobachtet werden.
Ergänzung zu F. graminearum: Francis und Burgess unterschieden 1977 innerhalb dieser Art zwei Gruppen:
Die Gruppe 1 verursacht an Getreide Fusskrankheiten. Ihre Vertreter bilden Chlamydosporen (Bockhus et al. 2010), sind heterothallische und wurden später in F. pseudograminearum (Hauptfruchtform Gibberella coronicola) umbenannt (Aoki und O'Donnell 1999).
Die Gruppe 2 verursacht Ährenfusariosen. Alle Arten dieser Gruppe sind homothallisch. Aufgrund neuer Erkenntnisse befinden sich in dieser Gruppe neun eindeutig unterscheidbare Arten (O'Donnell et al. 2004). Der Name F. graminearum sensu stricto blieb der weltweit am häufigsten vorkommenden Art vorbehalten, welche Ährenfusariosen verursacht.
 Abb. 4. Ein mit Fusarien befallener Maiskolben nach der Überwinterung im Freien. Die schwarzen, kugeligen Fruchtkörper auf den Lieschen und Körnern sind Perithecien der Hauptfruchtform Gibberella zeae. In den Perithecien befinden sich Asci mit je 8 Ascosporen (Abb. 5). Diese werden zum Zeitpunkt der Weizenblüte aus den Asci entlassen und durch Wind, Regen oder Insekten verbreitet. So gelangen sie auf die Ähren von Getreide und infizieren die Blüten.
Abb. 4. Ein mit Fusarien befallener Maiskolben nach der Überwinterung im Freien. Die schwarzen, kugeligen Fruchtkörper auf den Lieschen und Körnern sind Perithecien der Hauptfruchtform Gibberella zeae. In den Perithecien befinden sich Asci mit je 8 Ascosporen (Abb. 5). Diese werden zum Zeitpunkt der Weizenblüte aus den Asci entlassen und durch Wind, Regen oder Insekten verbreitet. So gelangen sie auf die Ähren von Getreide und infizieren die Blüten.
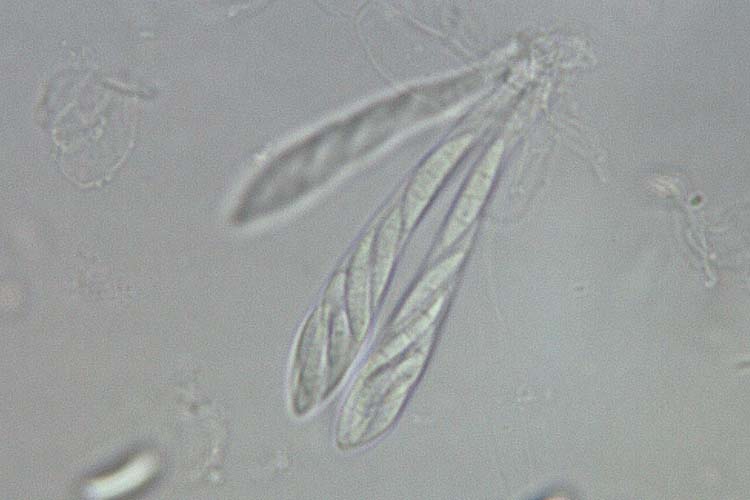
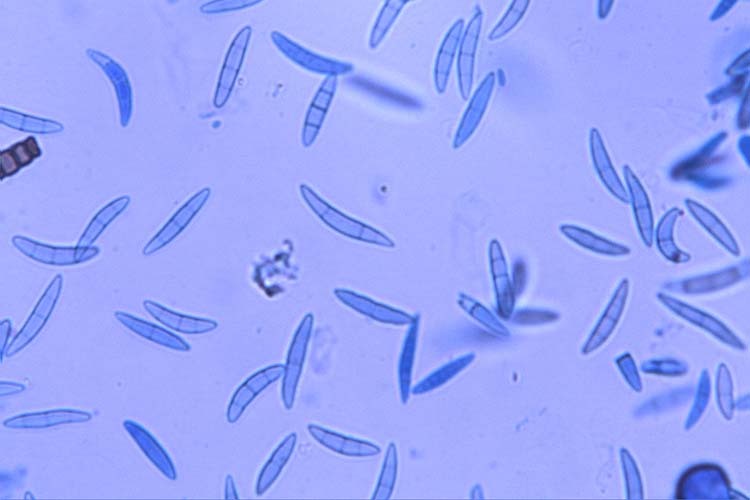 Abb. 5. Asci mit Ascosporen (oben) und Ascosporen (unten) der Gibberella zeae (Hauptfruchtform der F. graminearum)
Abb. 5. Asci mit Ascosporen (oben) und Ascosporen (unten) der Gibberella zeae (Hauptfruchtform der F. graminearum)
Lebenszyklus von F. graminearum (Gibberella zeae)
F. graminearum überwintert im oder auf dem Boden an Ernterückständen von Weizen, Gerste, anderen Getreidearten und Mais. An den befallenen Pflanzenresten (besonders an Maisstoppeln) entwickelt sich die Hauptfruchtform in Form kleiner kugeliger Fruchtkörper (Perithezien) (Abb. 4). In diesen wachsen Asci mit Ascosporen (Abb. 5). Letztere werden zum Zeitpunkt der Getreideblüte aus den Asci entlassen und durch Wind, Regen oder Insekten verbreitet. So gelangen sie auf die Ähren der verschiedenen Getreidearten und infizieren die Blüten. Der Pilz dringt dabei nicht direkt durch die Epidermis, sondern durch natürliche Öffnungen wie Spaltöffnungen (Stomata), die Basis der Deck- und Vorspelzen sowie die freiliegenden Staubbeutel (Antheren) (Bushnell et al. 2003). Einmal in der Blüte, wächst F. graminearum über die Leitbündel (Xylem und Phloem) von einem Ährchen zum nächsten. Bei nasser Witterung kann sich der Pilz auch auf der Oberfläche der Spelzen ausbreiten.
Durch das Eindringen des Pilzes in die Leitbahnen wird die Wasser- und Nährstoffzufuhr zu den höher liegenden Ährchen unterbrochen, was das typische Bild der partiellen Taub- oder Weissährigkeit verursacht. An den Ähren kommt es bei feuchtwarmer Witterung zur massenhaften Bildung der Nebenfruchtform mit ihren typischen lachsfarbenen Makrokonidien in Sporenlagern (Sporodochien).
Bereits beim Auskeimen der Sporen auf der Oberfläche der Spelzen bildet F. graminearum das Mykotoxin Deoxynivalenol (DON). Dieses hemmt die Proteinsynthese und schädigt die Zellmembran. Dadurch wird die Ausbreitung des Pilzes in der Pflanze ermöglicht und die Abwehr der Pflanze geschwächt und verlangsamt (Ludewig et al. 2005; Cumagun et al. 2004; Miller und Ewen 1997).
Neben dem sexuellen Lebenszyklus kann F. graminearum auch über asexuell gebildete Konidien eine Ährenfusariose verursachen. Im Frühjahr beginnt das überwinterte Myzel bei warmem, feuchtem Wetter erneut zu wachsen und bildet neue Makrokonidien. Diese werden durch Regenspritzer vom Boden auf die Blätter und von dort aus auf die Ähre transportiert.
Fusarium culmorum hat einen ähnlichen Lebenszyklus wie F. graminearum. Allerdings bildet F. culmorum keine Hauptfruchtform (Perithecien) aus, weshalb eine Infektion der Ähren mit Ascosporen nicht möglich ist, sondern nur mit Makrokonidien.
Epidemiologie
Fusarium-Arten sind weit verbreitete Bodenbewohner, die massgeblich am Abbau von zellulosehaltigen Pflanzenresten beteiligt sind. Von dort aus können sie junge Getreidepflanzen befallen und Keimlings- oder Fusskrankheiten verursachen. Eine Infektion kann auch von infiziertem Saatgut ausgehen und im Herbst zu Auflaufproblemen führen. Dazu benötigen die Pilze möglichst hohe Temperaturen. Dies ist auch der Grund, weshalb Keimlingskrankheiten bei uns keine wesentliche Rolle spielen (Miedaner 2011).
Die Zunahme minimaler Bodenbearbeitung und der Verzicht auf das Pflügen begünstigen ein vermehrtes Aufkommen der Ährenfusariosen. Auch enge Getreide-Mais-Fruchtfolgen und der Anbau von Weizen nach Mais bei gleichzeitig nicht sorgfältig eingearbeiteten Ernterückständen bilden ein hohes Infektionsrisiko.
Die Weizenähre ist während der Blüte am anfälligsten. Für die Stärke der Infektion sind neben dem Inokulum die Witterungsbedingungen zur Zeit der Blüte entscheidend. Infektionsfördernde Bedingungen herrschen bei feuchter Witterung mit Niederschlag oder hoher Luftfeuchtigkeit und Temperaturen von etwa 25 °C (Wilcoxson et al. 1992; Zinkernagel et al. 2000).
Trockenstress kann bei Weizen zu einem verstärkten Befall mit Ährenfusariosen führen, da die geschwächten Pflanzen dem Pilz bessere Infektionsbedingungen bieten. Dann werden auch Sorten geschädigt, die unter anderen Bedingungen resistent sind (Miedaner 2011).
Die Witterung beeinflusst auch die Mykotoxinproduktion. Typ A Trichothecene werden bei mässig warmen (Optimum zwischen 20 und 25 °C) und feuchten Bedingungen gebildet. Die optimale Temperatur für die Bildung von Typ-B Trichothecene und Moniliformin liegt bei 25-28 °C. Im Gegensatz dazu weist die Bildung von Zearalenon ein weites Optimum von 17-28 °C auf (Doohan et al. 2003).
Mykotoxine
Mykotoxine sind Naturstoffe, die für Mensch, Tier und Pflanze giftig sind. Je nach Fusarium-Art werden unterschiedliche Toxine gebildet (Tabelle 1): Trichothecene. Zearalenon, Moniliformin und Fumonisine.
Die Stoffklasse der Trichothecene wird in zwei Typen unterteilt: Zu den Typ-A Trichothecenen gehören das T-2 und das HT-2 Toxin, zu den Typ-B Trichothecenen das Deoxynivalenol (DON) und das Nivalenol (NIV). Typ-A Trichothecene sind im Allgemeinen giftiger als Typ B-Trichothecene.
Trichthecene sind sehr stabil und werden durch Verarbeitungsprozesse wie Mahlen, Backen und Brauen nicht zerstört. Sie verhindern bei Pflanzen und Tieren die Biosynthese von Eiweiss. Das wichtigste Fusariumtoxin, das DON, schwächt zudem das menschliche Immunsystem und verursacht Durchfall und Erbrechen. Schweine reagieren besonders empfindlich auf hohe Toxingehalte im Futter. Gehalte über 10 mg/kg Futter lösen akute Symptome wie Erbrechen (DON wurde früher auch Vomitoxin genannt) und Futterverweigerung aus. Die wiederholte Aufnahme von DON führt zu Beeinträchtigungen der Schleimhäute im Mund- und Rachenbereich, zu Schäden des Darms, der Leber, der Nieren, des Pankreas, des Lymphsystems sowie der Immunabwehr (Lepschy 1992, Ueno 1983).
Aufgrund der hohen Giftigkeit der Trichothecene wurden in der Schweiz und der EU Grenzwerte für die Verwendung von Getreide als Lebensmittel verfügt. So wurde beispielsweise der Grenzwert für den DON-Gehalt für unverarbeitetes Getreide (ausgenommen Hartweizen, Hafer und Mais) bei 1’250 µg pro kg festgelegt.
In der Schweiz werden Grenzwerte für den Mykotoxingehalt in der Verordnung des EDI über die Höchstgehalte für Kontaminanten (Kontaminantenverordnung, VHK) geregelt. Für Futtermittel gibt es Richtwerte als Empfehlung.
Innerhalb der EU sind die Mykotoxin-Höchstmengen für unverarbeitetes Getreide, das als Lebensmittel verwendet wird, in den Verordnungen EG1126/2007 beziehungsweise EG 1881/2006 sowie für T-2 und HT-2-Toxine in der Verordnng 2013/165/EU geregelt (Miedaner et al. 2018). Für Futtermitteln gibt es in der EU Richtwerte, bei deren Einhaltung die Tiergesundheit nicht gefährdet ist (2006/576/EG).
Zearalenon ist ein weiteres Fusarientoxin mit östrogener Wirkung, weshalb es auch als Phytoöstrogen bezeichnet wird. Wiederkäuer können das Zearalenon im Pansen abbauen. Bei Schweinen kann es nach Verabreichung von Zearalenon zu einer krankhaften Vergrösserung von Vulva und Uterus kommen, was zu Fruchtbarkeitsstörungen oder Aborten führen kann.
Das Mykotoxin Moniliformin wird von Fusarium avenaceum gebildet. Es schädigt die Muskeln, insbesondere den Herzmuskel.
F. verticillioides, F. proliferatum und F. subglutinans bilden die Fumonisine B1 bis B4. Diese Gruppe von Mykotoxinen wird vor allem in Mais in hohen Mengen gefunden. Ihnen wird eine kanzerogene Wirkung nachgesagt.
Tabelle 1: Wichtige Fusarium-Arten im Getreidebau und deren Mykotoxine
|
Fusarium-Arten |
Toxingruppe |
Mykotoxin |
Wirkung |
|
F. equiseti F. poae |
Typ A Trichothecen |
T2-Toxin HT2-Toxin |
Magen-Darmtoxin, Immunotoxizität |
|
F. graminearum F. culmorum F. poae F. equiseti F. pseudograminearum |
Typ B Trichothecen |
Deoxynivalenol (DON) Nivalenol |
Magen-Darmtoxin, Erbrechen, Durchfall, Immunotoxizität |
|
F. avenaceum |
Moniliformin |
Atemnot, Muskelschwäche (Herzmuskel) |
|
|
F. graminearum F. culmorum F. pseudograminearum F. equiseti |
Zearalenon |
östrogene Wirkung, verminderte Fruchtbarkeit |
Wirtsspektrum
Zu den Wirtspflanzen gehören alle Getreidearten sowie Mais und zahlreiche Gräser. Am anfälligsten ist Hartweizen, gefolgt von Brotweizen, Triticale und Roggen. Bei später Abreife ist auch der Hafer stark gefährdet. Gerste ist am widerstandsfähigsten.
Resistenz
Die Getreidepflanze kann sich auf unterschiedliche Art und Weise gegen einen Befall durch Fusarium wehren.
Langstrohige Sorten sind in der Regel weniger anfällig als kurzstrohige. Vermutlich erreichen die Pilzsporen die Ähren langstrohiger Sorten seltener, da die Distanz zwischen den Pflanzenresten am Boden und den Ähren grösser ist. Neue Erkenntnisse zeigen jedoch auch, dass das Pflanzenhormon Gibberellinsäure, welches das Längenwachstum der Pflanze steuert, auch eine direkte, hemmende Wirkung auf das Eindringen der Fusarium-Pilze hat.
Begrannte Sorten und solche mit weniger dichten Ähren werden weniger stark von Fusarien befallen.
Die Schweizer Winterweizensorte Arina zeigt regelmässig deutlich bessere Resistenzeigenschaften gegen Fusarien als neuere Weizensorten. Diese Resistenz beruht auf zahlreichen Genen (QTL), die einzeln jeweils nur eine geringe Wirkung haben. Eine solche quantitative Resistenz konnte auch in verschiedenen europäischen, amerikanischen und asiatischen Weizensorten nachgewiesen werden (Miedaner 2011). Die beste Sorte stammt von der chinesischen Landsorte Sumai 3, bei der ein paar wenige QTL (Fhb1 u.a.) rund 60 % der Resistenz erklären können.
Vorbeugende Massnahmen und Bekämpfung
- Fruchtfolge: Den Anteil von Mais und Getreide in der Fruchtfolge möglichst gering halten. Weizen nicht nach Mais säen, da Mais eine wichtige Wirtspflanze für viele Fusarium-Arten ist. Falls eine Aussaaat von Weizen nach Mais nicht vermieden werden kann, müssen die Ernterückstände der Maispflanzen zerkleinert und gründlich untergepflügt werden.
- Bodenbearbeitung: Im Frühjahr entstehen auf Stroh und Stoppelresten die Hauptfruchtkörper (Perithecien) von F. graminearum mit den Asci und den Ascosporen. Letztere sind hauptverantwortlich für die Infektion der Weizenähren zur Zeit der Blüte. Deshalb gilt: Erntereste von Mais und Getreide stets sorgfältig zerkleinern und einarbeiten sowie auf eine gute Verrottung achten. Das Ziel besteht darin, dass das Maisstroh bis zur Blüte des Getreides weitgehend verrottet ist (Miedaner et al. 2018).
- Sortenwahl: Wenig anfällige Sorten wählen (Sortenliste Schweiz). Langstrohige Sorten und Sorten mit kurzer Vegetationsdauer werden weniger stark befallen.
- Die Verwendung von gesundem Saatgut (anerkanntes Z-Saatgut) kann Fusarium-Keimlings- und Fusskrankheiten verhindern.
- Saatgutbehandlung: Warm- und Heisswasserbeizung, Mikroorganismenpräparate Cerall ® und Serenade, alkoholhaltige Pflanzenstärkungsmittel Lebermooser und Milsana ® sowie Ethanol (70%), Tillecur ® oder chemische Beizmittel
- Halmverkürzer zurückhaltend einsetzen. Das Gleiche gilt für reifeverzögernde Stickstoffgaben. Lagerndes Getreide ist unbedingt zu vermeiden.
- Massnahmen zur Ernte: Eine rechtzeitige Ernte ist wichtig; Parzellen mit mehr als 10 % befallenen Ähren sollten separat geerntet und abgeliefert werden. Der Mähdrescher sollte so eingestellt sein, dass möglichst alle Strohanteile, Spelzen sowie Schmachtkörner ausgeschieden werden. Feuchtes Saatgut sofort auf unter 14 % Wassergehalt trocknen.
- Den Schweinen kein mit Fusarien befallenes Stroh einstreuen
- Eine gezielte Fungizidbehandlung ist zur Zeit der Blüte möglich. Die Wahl des Mittels und die Aufwandmenge müssen sich nach dem Erregerspektrum, dem Anwendungstermin und der Sortenanfälligkeit ausrichten. Der Zeitpunkt wird vom Witterungsgeschehen bestimmt und sollte nach dem Ährenschieben maximal zwei Tage vor oder nach einem infektionsfördernden Regen erfolgen. Das schweizerische Prognosemodell „fusaprog“ kann dem Landwirt dabei helfen, zu entscheiden, ob eine Bekämpfungsmassnahme nötig ist.
- Empfohlene und zugelassene Pflanzenschutzmittel zum Schutz gegen Ährenfusariosen finden Sie für die Schweiz im BLW Pflanzenschutzmittelverzeichnis (Bundesamt für Landwirtschaft); für Deutschland in der online Datenbank des BVL (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) und für Österreich im Pflanzenschutzmittelregister des BAES (Bundesamt für Ernährungssicherheit).
Literatur
Aoki T, O'Donnell K, 1999. Morphological and molecular characterization of Fusarium pseudograminearum sp. nov., formerly recognized as the Group 1 of Fusarium graminearum and PCR primers for its identification. Mycologia 91: 597-609.
Bockus WW, Bowden RL, Hunger RM, Morrill WL, Murray TD, Smiley RW, 2010. Compendium of wheat Diseases and Pests. Third edition. The American Phytopathological Society, St. Paul Minnesota: 171 p.
Bushnell WR, Hazen BE, Pritsch C, 2003. Histology and physiology of Fusarium head blight. In KJ Leonard, WR Bushnell, eds, Fusarium Head Blight of Wheat and Barley. APS Press, St. Paul, MN, pp 44–83
Cumagun CJR, Bowden RL, Jurgenson JE, Leslie JF, Miedaner T, 2004. Genetic mapping of pathogenicity and aggressiveness of Gibberella zeae [Fusarium graminearum] toward wheat. Phytopathology 94: 520-526.
Doohan F M, Brennan J, Cooke BM, 2003. Influence of climatic factors on Fusarium species pathogenic to cereals. European Journal of Plant Pathology, 109: 755-768.
Lepschy J, 1992. Fusarientoxine in Getreide – ihre Entstehung und Vorbeugungsmaßnahmen. Gesunde Pflanze 44: 35-39.
Ludewig A, Kabsch U, Verreet JA, 2005. Comparative deoxynivalenol accumulation and aggressiveness of isolates of Fusarium graminearum on wheat and the influence on yield as affected by fungal isolate and wheat cultivar. Journal of Plant Diseases and Protection 112: 329-342.
Miedaner T, 2011. Resistenzgenetik und Resistenzzüchtung, DLG-Verlags-GmbH, Frankfurt/M., 237 S.
Miedaner T, Beyer W, Flath K, Hausladen H, Holtschulte B, Kessel B, Koopmann B, Schubiger FX, von Tiedemann A, Zellner M, 2018. Management von Pilzkrankheiten im Ackerbau. Agrimedia, Erling Verlag: 280 S.
O'Donnell K, Ward TJ, Geiser DM, Kistler HC, Aoki T, 2004. Genealogical concordance between mating type locus and seven other nuclear genes supports formal recognition of nine phylogenetically distinct species within Fusarium graminearum clade. Fungal Genet Biol 41: 600-623
Ueno, Y, 1983. Trichothecenes - Chemical, Biological and Toxicological Aspects. Tokyo/Amsterdam: Kodansha/Elsevier, 313 S.
Wiese MV, 1977. Compendium of wheat diseases. APS Press, St. Paul, MN, 106 S.
Wilcoxson RD, Busch RH, Ozmon EA, 1992. Fusarium head blight resistance in spring wheat cultivars. Plant Disease 76: 658-661.
Zinkernagel V, Adolf B, Habermeyer J, 2000. Ähreninfektionen bei Weizen durch Fusarium graminearum [Ear infections by Fusarium graminearum headblight of wheat]. Gesunde Pflanzen 52: 228-233



