Weizenbraunrost
rouille brune (franz.), wheat leaf rust or brown rust (engl.)
Wissenschaftlicher Name: Puccinia triticina Eriks.
Synonyme: Uredo rubigo-vera DC., Puccinia rubigo-vera (DC.) Winter, P. recondita Dietel & Holw., P. recondita f.sp. triticina D.M. Hend., P. recondita f.sp. tritici C.O. Johnson, P. dispersa Erikss. & Henning, P. dispersa f.sp. tritici Erikss. & Henning
Der wissenschaftliche Name des Roggenbraunrosts ist Puccinia recondita und des Braun- oder Zwergrosts der Gerste Puccinia hordei.
Taxonomie: Fungi, Basidiomycota, Pucciniomycetes, Pucciniales, Pucciniaceae
Weizenbraunrost (Puccinia triticina) ist ein wirtswechselnder Rostpilz mit vollständigem Entwicklungszyklus. Die wichtigsten Hauptwirte sind Brotweizen und Dinkel. Die Wiesenraute (Thalictrum speciosissimum) dient als Zwischenwirt. Die rostbraunen Sommersporenlager (Uredolager) wachsen vorwiegend an der Blattoberseite und sind über die gesamte Blattfläche verteilt. Im Herbst werden an der Blattunterseite schwarze Wintersporenlager (Teleutosporenlager) gebildet. In gemässigten Klimazonen ist der Braunrost nicht auf den Zwischenwirt angewiesen. Er überdauert den Winter meist als Myzel oder in Form von Sommersporen an Ausfallgetreide und/oder Winterweizen. Die wichtigste Massnahme zur Vermeidung der Ertragseinbussen durch Braunrost ist die Wahl von resistenten oder wenig anfälligen Weizensorten.

 Abb. 1. Weizenbraunrost (Puccinia triticina): Uredolager
Abb. 1. Weizenbraunrost (Puccinia triticina): Uredolager
 Abb. 2. Weizenbraunrost (Puccinia triticina): Teleutolager
Abb. 2. Weizenbraunrost (Puccinia triticina): Teleutolager
Schadbild
Die rostbraunen Uredolager (Sommersporen) wachsen vorwiegend an der Blattoberseite (Abb. 1 und 3). Sie sind über die ganze Blattfläche verteilt (nicht in Reihen oder Streifen angeordnet wie beim Gelbrost, P. striiformis) und kommen auch selten an den Blattscheiden und Ähren vor. Die rundlichen Lager haben einen Durchmesser von etwa 2 mm und sind meist von einem gelben Hof umgeben. Im Unterschied zum Schwarzrost (P. graminis) bleiben am Rande der Lager nur wenige Epidermisreste hängen.
Gegen Ende der Vegetationsperiode werden an der Blattunterseite und gelegentlich auch an der Blattscheide Teleutosporenlager gebildet. Diese sind schwarz, länglich und von der Epidermis bedeckt (Abb. 2 und 3).
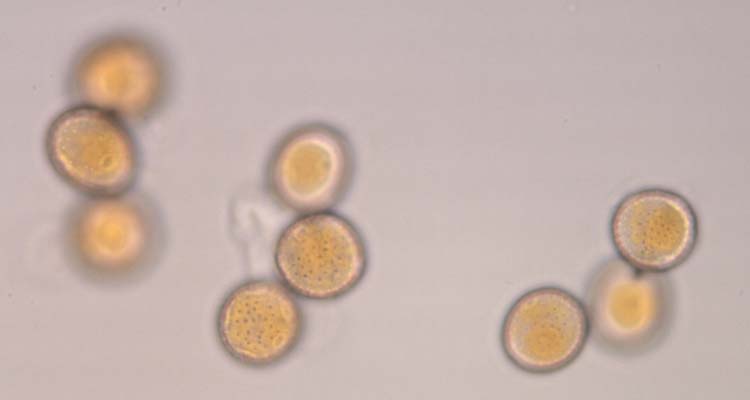
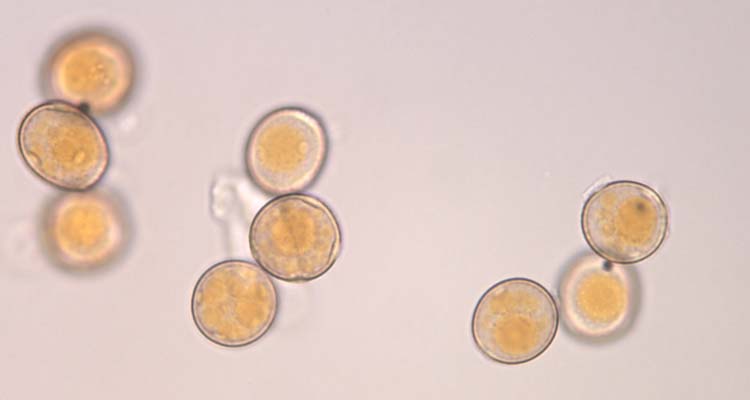 Abb. 4. Weizenbraunrost (Puccinia triticina): Uredosporen (Sommersporen) mit Stachelwarzen (oben) und Keimporen (unten)
Abb. 4. Weizenbraunrost (Puccinia triticina): Uredosporen (Sommersporen) mit Stachelwarzen (oben) und Keimporen (unten)
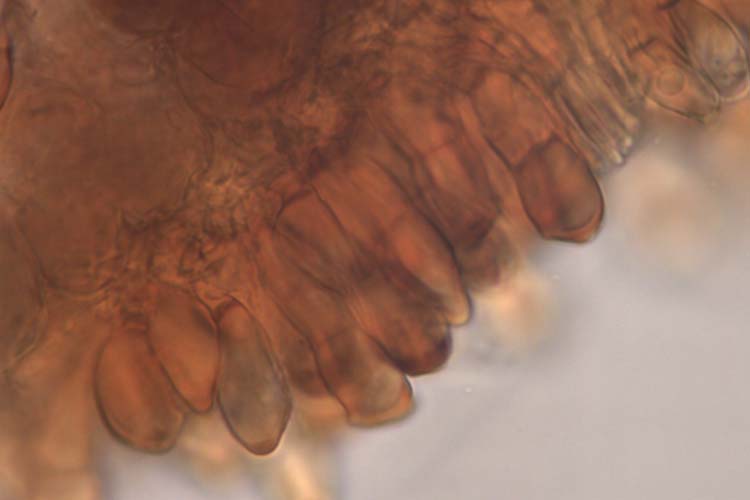
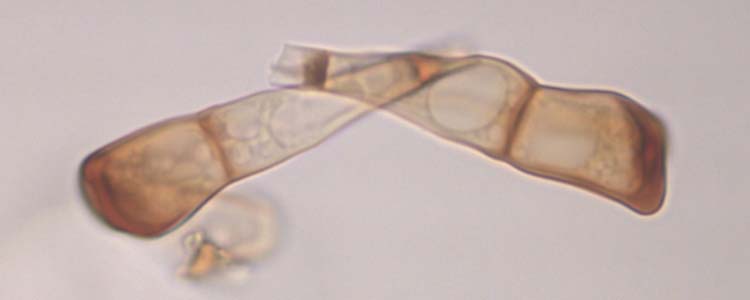 Abb. 5. Weizenbraunrost (Puccinia triticina): Schnitt durch ein Teleutosporenlager (oben) und Teleutosporen (Wintersporen) (unten)
Abb. 5. Weizenbraunrost (Puccinia triticina): Schnitt durch ein Teleutosporenlager (oben) und Teleutosporen (Wintersporen) (unten)
Krankheitserreger
Die Uredosporen (Abb. 4) sind kugelig bis ellipsoid, im Mittel 23.2 µm lang und 20.4 µm breit (Anikster et al 2005). Sie besitzen 8-10 gleichmässig verteilte Keimporen und sind mit Stachelwarzen versehen (Gäumann 1959). Die Uredosporen sind orangebraun (nicht hyalin wie bei P. striiformis). In den Uredolagern gibt es keine Paraphysen.
Die braunen bis schwarzen Teleutosporen sind zweizellig (Abb. 5), länglich keulenförmig (45.9 µm lang und 16.3 µm breit, Anikster et al. 2005) und oft abgestumpft oder schräg abgestutzt. Die untere Zelle ist in der Regel schmäler und länger als die obere. Die Keimporen sind nicht sichtbar. Der Stiel ist kurz. Bräunliche Paraphysen unterteilen die grossen Lager in kleinere Lager.
Laut Anikster et al. 2005 messen die Basidiosporen 8.27 x 6.28 µm, die Spermatien 3.93 x 2.28 µm und die Aecidiosporen 20.1 x 17.1 µm.
Lebenszyklus
Weizenbraunrost ist ein wirtswechselnder (heterözischer) Rostpilz mit vollständigem (makrozyklischem) Entwicklungszyklus. Er bildet zweikernige (dikaryotische) Uredosporen in Uredolagern. Diese infizieren wiederholt den Weizen, so dass es unter günstigen Witterungsbedingungen zu einer epidemieartigen Ausbreitung des Rostpilzes kommt. Mit zunehmender Reife des Weizens werden die Teleutosporen in Teleutolagern gebildet. Diese sind zunächst ebenfalls zweikernig. Die beiden haploiden Zellkerne verschmelzen jedoch bald darauf zu einem diploiden Zellkern (Karyogamie).
Die Teleutosporen sind Dauersporen, die den Winter überdauern können. Im Mittelmeerraum dienen sie hingegen der Überbrückung des heissen, trockenen Sommers. In gemässigten Klimazonen ist der Braunrost nicht unbedingt auf den Zwischenwirt angewiesen: Hier überdauert er den Winter meist als Myzel oder in Form von Uredosporen auf Ausfall- und/oder Winterweizen.
Im Frühjahr (im Mittelmeerraum im Herbst) keimt eine oder beide Zellen der Teleutospore mit einem Promyzel. Der diploide Zellkern teilt sich in einer Meiose in vier haploide Zellkerne. Diese wandern in das Promyzel, welches sich anschliessend mittels Septen in vier Zellen mit je einem haploiden Zellkern unterteilt. Letztere fliessen anschliessend durch die Sterigmen in die neu entstehenden vier Basidiosporen. Die Basidiosporen werden abgestossen und gelangen mit der Luftströmung auf den Zwischenwirt, die Wiesenraute (Thalictrum speciosissimum). Dort keimen die Basidiosporen und dringen direkt in das Blatt ein. Es bilden sich flaschenförmige Spermogonien (Pyknidien), in denen Spermatien (früher als Pyknosporen bezeichnet) und Empfängnishyphen entstehen. Regentropfen, Tau oder Insekten, die durch einen von den Spermogonien ausgeschiedenen "Nektar" angelockt werden, übertragen die Spermatien auf sexuell kompatible Empfängnishyphen. Nach der Befruchtung entwickeln sich auf der Blattunterseite Aecidien, in denen in Ketten angeordnete, dikaryotische Aecidiosporen wachsen. Diese Sporen infizieren nun wiederum den Hauptwirt, den Weizen.
Infektionsvorgang und Resistenzreaktion
Uredosporen können mit dem Wind über mehrere Kilometer verbreitet werden. Gelangt eine Uredospore auf ein anfälliges Weizenblatt und ist dort ein Wasserfilm vorhanden (beispielsweise verursacht durch Regen oder Tau), keimt sie bereits nach 4 bis 8 Stunden bei 20 °C. Der Keimschlauch wächst senkrecht zur Längsachse der Epidermiszellen an der Blattoberfläche, bis er auf eine Spaltöffnung (Stoma) trifft. Dort wird ein Appressorium gebildet. Eine Penetrationshyphe dringt durch die geschlossene Spaltöffnung in die Pflanze ein und bildet in den Pflanzenzellen Haustorien. Das sind spezialisierte pilzliche Hyphen, die der Nährstoffversorgung des Pilzes dienen, ohne die Wirtszelle dabei abzutöten.
Sieben bis zehn Tage nach Beginn der Infektion entstehen unter der Epidermis die ersten Uredosporen. Sobald genügend Sporen gebildet wurden bricht die Epidermis auf und die Sporen werden vom Wind verbreitet. An sehr anfälligen Weizenpflanzen werden rund um das primäre Uredolager noch weitere, sekundäre Lager gebildet. Selbst 16 Tage nach dem Eindringen des Pilzes in die Pflanze sind nur wenige Pflanzenzellen abgestorben.
Wenn eine Uredospore auf eine resistente Weizenpflanze gelangt, dringt sie, wie oben beschrieben, in das Blatt ein. Die Entwicklung eines Haustoriums wird jedoch verhindert, da die Pflanzenzelle eine hypersensitive Resistenzreaktion auslöst, durch die sie sich selbst tötet.
Braunrostrassen
Die verschiedenen Rassen unterscheiden sich in ihrer Fähigkeit, bestimmte Weizensorten zu befallen oder nicht zu befallen. Die Braunrostpopulationen sind weltweit sehr divers. In den USA konnten in einem Jahr bis zu 70 verschiedene Weizenbraunrostrassen identifiziert werden (Kolmer et al. 2007). In Frankreich wurden 30-50 (Goyeau et al. 2006) und in Australien 10-15 Rassen (Park 1996) bestimmt.
Neue Braunrostrassen entstehen auf dem Zwischenwirt durch Genrekombination oder durch natürlich vorkommende, zufällige Mutationen in den Uredosporen. Oft kommt es vor, dass Rostrassen in ein Gebiet einfliegen oder eingeschleppt werden, in dem sie bisher nicht auftraten. Dies kann bei den Rostpilzen über sehr grosse Distanzen hinweg stattfinden.
Epidemiologie
Weizenbraunrost entwickelt sich bei hohen Tagestemperaturen (über 25 °C) und kühlen Nächten (unter 15 °C) mit Taubildung besonders gut (Häni et al. 2008). Der Anbau anfälliger Sorten, eine hohe Stickstoffversorgung und der Einsatz von Wachstumsreglern begünstigen eine rasche Vermehrung des Rostpilzes zusätzlich. Die Krankheit erscheint meist relativ spät und verursacht deshalb nur selten einen ins Gewicht fallenden Ertragsausfall, ausser bei spät reifenden Sorten. Myzel und Uredosporen überleben tiefe Temperaturen problemlos, so dass der Rostpilz auch ohne Zwischenwirt in der Region überleben kann.
Wirtsspektrum
Uredosporen von Puccinia triticina befallen Brotweizen (Triticum aestivum L.), Dinkel (T. aestivum subsp. spelta (L.) Thell.), tetraploiden Hartweizen (T. durum) und den ebenfalls tetraploiden Emmer (T. turgidum var. dicoccum Schübler).
Der Zwischenwirt von P. triticina ist die gelbe Wiesenraute (Thalictrum speciosissimum = T. flavum) (Anikster et al. 1997).
Weizensorten unterscheiden sich in der Anfälligkeit gegenüber Braunrost. Sie tragen ein oder mehrere Resistenzgene. Diese können von bestimmten Braunrostrassen überwunden werden (= Rostrasse ist virulent), was zu einer Infektion und zur Bildung von Uredosporen führt. Pflanzen die Resistenzgene enthalten, welche von dieser bestimmten Rasse nicht überwunden werden können (d.h. die Rostrasse ist avirulent), bleiben gesund.
Die Pflanzenzüchter versuchen breit wirksame Resistenzgene in einer Weizensorte zu vereinen, um diese gegen möglichst viele Rostrassen dauerhaft resistent zu machen. Die Resistenzzüchtung erleidet aber immer wieder Rückschläge, da neue Rostrassen entstehen oder neue Rassen in zuvor nicht besiedelte Gebiete einwandern können. Deshalb wird in Landrassen, verwandten Arten sowie Wild- und Urformen des Weizens weiterhin nach neuen Resistenzgenen gesucht. Diese sind jedoch meist mit Genen gekoppelt, die negative agronomische Eigenschaften vererben, so dass sie nicht genutzt werden können.
Vorbeugende Massnahmen und Bekämpfung
- Die wichtigste Massnahme, um Ertragseinbussen durch Braunrost zu vermeiden, ist die Wahl resistenter Weizensorten. In den jeweiligen Listen der empfohlenen Getreidesorten (Schweiz: Liste der empfohlenen Getreidesorten; Deutschland: Sortenliste des Bundessortenamtes; Österreich: Österreichische beschreibende Sortenliste) sind die Resistenzeigenschaften der Sorten aufgeführt. In einigen Fällen werden auch Sortenmischungen empfohlen.
- Winterweizen sollte nicht zu früh gesät werden, um Herbstinfektionen zu vermeiden, und Sommerweizen sollte nicht zu spät gesät werden (Häni et al. 2008).
- Um den Lebenszyklus des Braunrosts zu unterbrechen, ist es sinnvoll, Ausfallgetreide vor dem Auflaufen der Herbstsaat zu beseitigen.
- Gut mit Stickstoff versorgte Weizenpflanzen sind anfälliger für Braunrost. Deshalb sollte der Stickstoff zurückhaltend eingesetzt und die Einzelgaben nicht zu hoch dosiert werden.
- Da Braunrost relativ spät auftritt, ist meist keine chemische Bekämpfung nötig.
- Eine direkte Bekämpfung mit chemischen Pflanzenschutzmitteln ist jedoch möglich. In der Schweiz sind Betriebe, die gemäss dem ökologischen Leistungsnachweis (ÖLN) wirtschaften, verpflichtet, Pflanzenschutzmittel nur gemäss dem Schadschwellenprinzip anzuwenden. Schadschwellen, beziehungsweise Bekämpfungsschwellen, geben einen Anhaltspunkt, ab welcher Dichte eine Bekämpfung mit Pflanzenschutzmitteln erfolgen soll und wirtschaftlich sinnvoll ist.
Die Bekämpfungsschwelle für Braunrost an Weizen und Triticale ist in der Schweiz wie folgt festgesetzt (Agridea, Datenblätter Ackerbau): Während der Entwicklungsstadien 37 (Fahnenblattspitze sichtbar) bis 61 (Beginn der Blüte) werden 40 Halme über die Felddiagonale eingesammelt und die drei obersten, vollentwickelten Blätter pro Halm auf Befall kontrolliert. Die Anzahl der befallenen Blätter (von insgesamt 120) wird gezählt. Die Bekämpfungsschwelle ist erreicht, falls bei anfälligen Sorten ein bis fünf Blätter (1 bis 4 Prozent), bei wenig anfälligen Sorten zehn Blätter (ca. zehn Prozent) befallen sind. - Empfohlene und zugelassene Pflanzenschutzmittel gegen Braunrost (Puccinia triticina) finden Sie für die Schweiz im BLW Pflanzenschutzmittelverzeichnis (Bundesamt für Landwirtschaft); für Deutschland in der online Datenbank des BVL (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) und für Österreich im Pflanzenschutzmittelregister des BAES (Bundesamt für Ernährungssicherheit)
Literatur
Agridea, 2021. Datenblätter Ackerbau. AGRIDEA, CH-8315 Lindau (Bekämpfungsschwellen)
Anikster Y, Bushnell WR, Eilam T, Manisterski J, Roelfs AP, 1997. Puccinia recondita causing leaf rust on cultivated wheats, wild wheats and rye. Can. J. Bot. 75: 2082-2096.
Anikster Y, Eilam T, Bushnell WR, Kosman E, 2005. Spore dimensions of Puccinia species of cereal hosts as determined by image analysis. Mycologia 97 (2): 474–484.
Bolten MD, Kolmer JA, Garvin DF, 2008. Wheat leaf rust caused by Puccinia triticina. Molecular plant pathology 9 (5): 563-575.
Gäumann E, 1959. Beiträge zur Kryptogamenflora der Schweiz (Band XII): Die Rostpilze Mitteleuropas, Büchler und Co. 1407 S.
Goyeau H, Park R, Schaeffer B, Lannou C, 2006. Distribution of pathotypes with regard to host cultivars in French wheat leaf rust populations. Phytopathology 96: 264-273.
Häni FJ, Popow G, Reinhard H, Schwarz A, Voegeli U, 2008. Pflanzenschutz im nachhaltigen Ackerbau. Edition LMZ, 7. Auflage. 466 S.
Kolmer JA, Long DL, Hughes ME, 2007. Physiological specialization of Puccinia triticina on wheat in the United States in 2005. Plant disease 91: 979-984.
Park RF, 1996. Pathogenic specialization of Puccinia recondita f.sp. tritici in Australia and New Zealand in 1990 and 1991. Australasian Plant Pathology 25: 12-17.



